
【题目】当1mol某气态烃与2mol Cl2发生加成反应时,分子中的不饱和碳原子全部转化为饱和碳原子,所得产物再与4mol Cl2进行取代反应后,生成只含C、Cl两种元素的化合物。则该气态烃是( )
A.乙炔B.乙烯C.丁二烯D.丙炔
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B. 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C. 0. 1 mol·L-1AgNO3溶液:H+、K+、SO42-、I-
D. 0. 1 mol·L-1NaAlO2溶液: H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只给出下列甲中和乙中对应的量,不能组成一个求物质的量浓度公式的是
序号 | ① | ② | ③ | ④ | ⑤ |
甲 | 物质微粒数 | 标准状况下 气体摩尔体积 | 溶质Na2SO4的质量 | 溶质KCl的 质量分数 | 非标准状况 下物质的质量 |
乙 | 阿伏加德罗常数 | 标准状况下 气体密度 | 溶液的体积 | 溶液的密度 | 物质的摩尔质量 |
A. ①②⑤ B. ①②④⑤ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 保存FeCl2溶液时,常加入少量铁粉 B. 用10mL量筒量取6.4mL的稀盐酸
C. 用溴水除去甲烷中的少量乙烯 D. 用分液漏斗分离苯和汽油的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的液态化合物XY2,与一定量O2在一密闭容器中恰好完全反应:XY2(液)+3O2(气)=XO2(气)+2YO2(气),冷却至标准状况,测得容器内气体的体积为6.72L,密度为2.5g/L。则:化合物XY2的摩尔质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小。某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
![]()
实验过程如下:在容积为l00mL的三颈烧瓶中将5mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,收集到粗产品,精制得到正丁醚。回答下列问题:
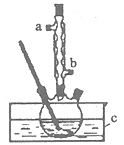
(1)合成粗产品时,液体试剂加入顺序是_________________。
(2)实验中冷凝水应从____口流出(填“a”或‘‘b”)。
(3)为保证反应温度恒定在135°C,装置C中所盛液体必须具有的物理性质为________。
(4)加热时间过长或温度过高,反应混合液会变黑,写出用浓NaOH溶液吸收有毒尾气的离子方程式________________。
(5)得到的正丁醚粗产品依次用8 mL50%的硫酸、10 mL水萃取洗涤。该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、________________________。
(6)本实验最终得到6.50g正丁醚,则正丁醚的产率是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0 mL于锥形瓶,加入10.0 mL KI溶液(足量),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1的Na2S2O3标准液,调整液面。记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3![]() 2NaI+Na2S4O6(Na2S4O6溶液为无色)。
2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是________ 。
(2)步骤①反应的离子方程式是________ 。
(3)步骤③当待测液由________ 色变为________色且30 s不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为________。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度________ (填“偏大”“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度______(填“偏大”“偏小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:

(1)铅蓄电池放电时,PbO2作_______极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。
①根据图l写出过程I的离子方程式:____。
② 生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低;
ii.__________________________________________(请你提出一种合理解释)。
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是__________________。(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
(4)过程Ⅲ,将PbO粗品溶解在HCI和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。阴极的电极反应式是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.6 g Na2CO3固体溶于水配成100 mL溶液。
(1) Na2CO3的摩尔质量为__________g/mol。
(2) Na2CO3的物质的量为____________mol。
(3)该溶液中Na2CO3的物质的量浓度为________ mol/L。
(4)从该溶液中取出10 mL,其中含Na+的物质的量为________ mol。
(5)取出的10 mL该溶液加水稀释,稀释后溶液中Na2CO3的物质的量浓度为0.1 mol/L,稀释后溶液体积为________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com