
| A. | 钢铁表面发生析氢腐蚀时,钢铁表面水膜的pH增大 | |
| B. | 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少 | |
| C. | 在镀件上电镀锌,可以用锌作阳极,用硫酸锌溶液作电解质溶液 | |
| D. | 原电池的负极和电解池的阴极上都是发生失电子过程 |
分析 A.钢铁表面发生析氢腐蚀时,正极上氢离子得电子发生还原反应生成氢气;
B.根据阳极材料组成以及电极反应分析判断;
C.电镀原理中,镀件金属作阳极,镀层金属作阴极;
D、工作时,原电池的负极上失电子,电解池的阴极上得电子.
解答 解:A.钢铁表面发生析氢腐蚀时,正极上氢离子得电子发生还原反应生成氢气,所以钢铁表面水膜的pH增大,故A正确;
B.电解精炼铜时,因为粗铜含有杂质,所以开始通电一段时间后,阳极溶解的铜的质量比阴极析出的铜的质量少,故B正确;
C.电镀原理中,镀层金属做阳极,镀件金属做阴极,则在镀件上镀锌,可以用锌作阳极,用硫酸锌作电解质溶液,故C正确;
D.工作时,原电池的负极上失电子发生氧化反应,电解池的阴极上得电子发生还原反应,故D错误;
故选D.
点评 本题考查了原电池和电解池原理,难度不大,明确原电池和电解池的区别.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操 作 | 溶液浓度 |
| 砝码放在左盘、NaOH固体放右盘进行称量(1g以下使用游码) | ① |
| 转移溶液时有少量液体洒落到容器外 | ② |
| 定容时俯视刻度线 | ③ |
| 摇匀后观察到液面低于刻度线,立即补充水到凹液面与刻度线水平相切 | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④ | C. | ①②③④ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
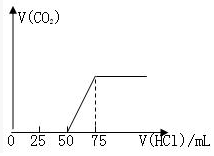 有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?
有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.2gNaCl固体 | B. | 用10mL量筒量取7.5mL稀盐酸 | ||
| C. | 用450mL的容量瓶配制450mL溶液 | D. | 用广泛pH试纸测得某溶液的pH为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
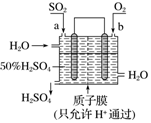
| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com