
分析 (1)ⅰ.CO的标准燃烧热:-283.0kJ•mol-1,所以CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1 ,
ⅱ. 2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g)△H=-15.5kJ•mol-1,利用盖斯定理将ⅰ+ⅱ可得2CH3OH(g)+CO(g)+$\frac{1}{2}$O2(g)?CH3OCOOCH3 (g)+H2O(g)△H;平衡常数为生成物与反应物浓度幂之积的比值;
(2)滴加甲酸,水解程度减小,抑制水的电离,中性溶液中C(Na+)=C(HCOO-)、C(H+)=C(OH-).
解答 解:(1))ⅰ.CO的标准燃烧热:-283.0kJ•mol-1,所以CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1 ,
ⅱ. 2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g)△H=-15.5kJ•mol-1,利用盖斯定理将ⅰ+ⅱ可得2CH3OH(g)+CO(g)+$\frac{1}{2}$O2(g)?CH3OCOOCH3 (g)+H2O(g)△H=-298.5kJ•mol-1,
K=$\frac{c(C{H}_{3}OCOOC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)•c(CO)•{c}^{\frac{1}{2}}({O}_{2})}$,
故答案为:-298.5kJ•mol-1;$\frac{c(C{H}_{3}OCOOC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)•c(CO)•{c}^{\frac{1}{2}}({O}_{2})}$;
(2)滴加甲酸,水解程度减小,抑制水的电离,水的电离平衡逆向移动,中性溶液中C(Na+)=C(HCOO-)、C(H+)=C(OH-),且C(Na+)=C(HCOO-)>C(H+)=C(OH-),
故答案为:逆向;C(Na+)=C(HCOO-)>C(H+)=C(OH-).
点评 本题考查较综合,涉及离子浓度大小比较、溶液pH计算、化学平衡时计算、盖斯定律等知识点,综合性较强,侧重考查学生分析计算能力,注意盖斯定律的运用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 可逆反应进行的程度是不可改变的 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 能自发进行的化学反应,一定是△H<0、△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 最高价氧化物对应水化物的酸性:N>M | |
| C. | 单质与水反应的剧烈程度:Z>Y | |
| D. | X和M的最高正价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
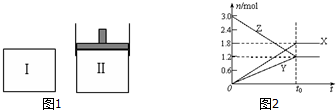
| A. | 该反应的化学方程式为:3X+2Y?2Z | |
| B. | 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 | |
| C. | 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 | |
| D. | 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 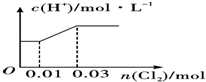 | B. |  | ||
| C. | 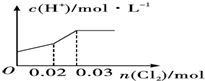 | D. | 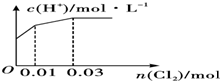 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况(室温、101kP)下,气体摩尔体积约为22.4L/mol | |
| C. | 标准状况(0℃、101kP)下,气体摩尔体积约为22.4 L | |
| D. | 标准状况(0℃、101kP)下,1 mol H2O的体积是22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com