
| 实验目的 | 实验操作 | |
| A | 证明乙烯能发生加成反应 | 将乙烯气体通入溴的四氯化碳溶液中 |
| B | 鉴别Fe(OH)3胶体和FeCl3溶液 | 用激光笔分别照射两种物质,从侧面观察是否出现光亮的通路. |
| C | 检验酒精中是否含有水 | 取少量酒精加入无水硫酸铜粉末 |
| D | 鉴别苯、环已烯和已烷 | 加入酸性高锰酸钾溶液 |
| A、A | B、B | C、C | D、D |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
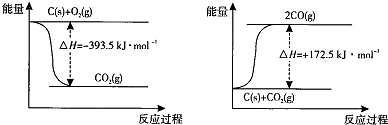
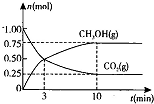
| 弱电解质 | H2CO3 | NH3.H2O |
| 电离平衡常数( 25℃) | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
| Kw |
| Kb |
| Kw |
| Ka2 |
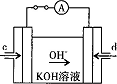
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变时,升高温度,化学反应速率加快 |
| B、其他条件不变时,增大反应物的浓度,化学反应速率加快 |
| C、化学反应达到一定限度即“平衡状态”时,正反应的速率与逆反应的速率相等 |
| D、化学反应达到一定限度即“平衡状态”时,反应物的浓度与生成物的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有0.1NA 个CO32-的Na2CO3固体的质量为10.6g |
| B、含1mol 溶质的盐酸溶液与足量Fe反应,消耗NA个Fe原子 |
| C、0.1mol?L-1的稀硫酸中含有SO42-个数为0.1NA |
| D、标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V2=10V1 |
| B、V1>10V2 |
| C、V2<10V1 |
| D、V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B、氯气和冷水反应:Cl2+H2O═2H++Cl-+ClO- |
| C、铝和烧碱溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2=V3 |
| B、若混合前三溶液pH相等,酸碱恰好完全反应,则V1=V2<V3 |
| C、若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1=V2=V3 |
| D、若混合前三溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com