
���� ��1����ɫ����Һ������ɫ�����Ӳ��ܹ��棻
��2��ȡ����ԭ��Һ�μӼ��η�̪��Һ����Һ���ɫ����ʵ�������˵��ԭ��Һ��ʾ���ԣ��������������ӣ�
��3��̼������ӿ��Ժ������ӷ�Ӧ�������壬�����Ӻ�̼������Ӳ����棬��������Ӻͱ����Ӳ����棻
��4�������ӿ��Ժ�������֮�䷴Ӧ�����Ȼ����������ݴ˻ش�
��� �⣺��1����ɫ����Һ������ɫ�����Ӳ��ܹ��棬����Fe2+��Cu2+�����κ�ʵ��Ϳ��Կ϶����ʴ�Ϊ��Fe2+��Cu2+��
��2��ȡ����ԭ��Һ�μӼ��η�̪��Һ����Һ���ɫ����ʵ�������˵��ԭ��Һ��ʾ���ԣ��������������ӣ���ʵ�������˵��ԭ��Һ�п϶������ڵ�������Ca2+��Mg2+��HCO3-�����ǿ��Ժ�����������֮�䷴Ӧ���ʴ�Ϊ��Ca2+��Mg2+��HCO3-��
��3����ȡ����ԭ��Һ��εμ������������������塢�������ɣ����Բ���CO32-���ټ���BaCl2��Һ���а�ɫ�������ɣ�һ������SO42-������һ��������Ca2+��
�ʴ�Ϊ��Ca2+��CO32-��
��4������3��ʵ�����û��Һ���ã�ȡ�����ϲ���Һ������AgNO3��Һ���а�ɫ�������ɣ��������AgCl�����Ǽ�����Ȼ������������ӣ����Բ���ȷ���Dz��Ǻ������ӣ���������ʵ���ƶϣ�ԭ��Һ�п϶����ڵ�������OH-��SO42-�����ݵ���غ㣬һ������Na+�����ܿ϶����ڵ�������Cl-��NO3-��
�ʴ�Ϊ��Na+��OH-��SO42-��Cl-��NO3-��
���� ���⿼�����ӵĹ��棬Ϊ��Ƶ���㣬����ϰ���е���Ϣ����Һ������Լ���������֮��ķ�ӦΪ���Ĺؼ���ע�⣨1��������������ж�Ϊ�����״��㣬��Ŀ�ѶȲ���


 �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ����������Ϊ7.8% | B�� | ��Һ�����ʵ���������7.8g | ||
| C�� | ��Һ��ˮ����������92.2g | D�� | ��Һ����������100g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� | H-H | Br-Br | I-I | H-CL | H-CL | H-I | H-Br |
| ���� | 436 | 193 | 243 | 431 | 431 | 298 | 366 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2 | B�� | N2O | C�� | NO | D�� | NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
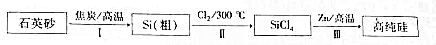
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �Ϻ�ijС���ϣ������õĵ�ˮ��Դ�൱�ѷ�����ž�սʿΪ��Ѱ�Һ��ʵ�����ˮԴ���Ե���ɽȪˮ���з������飬�����ʾɽȪˮ����Ӳˮ��
�Ϻ�ijС���ϣ������õĵ�ˮ��Դ�൱�ѷ�����ž�սʿΪ��Ѱ�Һ��ʵ�����ˮԴ���Ե���ɽȪˮ���з������飬�����ʾɽȪˮ����Ӳˮ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com