
【题目】为探究H2O2制备氧气,生成氧气速率的影响因素,某同学设计了如下一系列实验。
实验编号 | 反应物 | 催化剂 |
甲 | 试管中加入3 mL 2% H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
丁 | 试管中加入3 mL 5% H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
戊 | 试管中加入3 mL 5% H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
[查阅资料] 过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5%的H2O2溶液加热到65 ℃时就有氧气放出,加热到80 ℃时就有较多氧气产生。
(1)实验丙、实验丁和实验戊的实验目的是_____________________________________。
(2)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?______
(3)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验丁,20~40 s的反应速率v1=_____mL·s-1,100~120 s的反应速率v2=_____mL·s-1。不考虑实验测量误差,二者速率存在差异的主要原因是_____________________________________。
②如图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验 ______(填“丙”“丁”或“戊”)。

【答案】 探究在不同酸碱性条件下,催化剂对反应速率的影响 实验甲和实验乙不能达到实验目的,因为H2O2在常温且无催化剂作用的条件下较稳定 0.4 0.375 随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小 丁
【解析】(1)甲和乙实验中除双氧水的浓度不同外其他条件都相同,可知实验探究反应物的不同浓度对反应速率的影响;实验丙、实验丁和实验戊中溶液的酸碱性不同,且比实验乙多了使用催化剂,可知这三个实验是探究在不同酸碱性条件下,催化剂对反应速率的影响,故答案为:探究在不同酸碱性条件下,催化剂对反应速率的影响;
(2)根据资料可知H2O2在常温且无催化剂作用的条件下比较稳定,则实验甲和实验乙不能达到实验目的,故答案为:实验甲和实验乙不能达到实验目的;
(3)①根据表中数据和题中反应速率的单位可知v1=![]() =
=![]() mL/s=0.4mL/s,v2=
mL/s=0.4mL/s,v2=![]() =
=![]() mL/s=0.375mL/s,速率减小的原因是随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小,故答案为:0.4;0.375;随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小;
mL/s=0.375mL/s,速率减小的原因是随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小,故答案为:0.4;0.375;随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小;
②由图可知曲线c反应速率最小,在三个实验中,实验丁每次记录的气体体积都是最少的,说明丁的速率最小,曲线c代表实验丁,故答案为:丁。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O![]() 废水,如下图所示;电解过程中溶液发生反应:Cr2O
废水,如下图所示;电解过程中溶液发生反应:Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。

(1)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨Ⅰ是电池的________极;石墨Ⅰ附近发生的电极反应式为__________________________________。
(2)工作时,甲池内的NO![]() 向___________极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为____________。
向___________极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为____________。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为_________________________________。
(4)若溶液中减少了0.01 mol Cr2O![]() ,则电路中至少转移了___________mol电子。
,则电路中至少转移了___________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器发生可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
A. 正逆反应速率相等且等于零
B. NH3、O2、NO和H2O浓度均相等
C. NH3、O2、NO和H2O在容器中共存
D. NH3、O2、NO和H2O浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
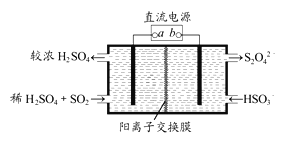
①阳极的电极反应式为__________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_________。
Ⅱ.乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
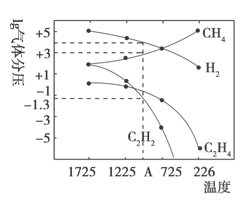
(2)T2℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
(3)列式计算反应2CH4(g) =C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=_________(用平衡分压代替平衡浓度计算:lg![]() ≈ -1.3)。
≈ -1.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )

A. 该反应为吸热反应
B. 该反应不需要加热就能进行
C. 1 molCO(g)和1mol H2O(g)具有的总能量大于1 molCO2(g)和1 molH2(g)具有的总能量
D. 1 molCO2(g)和1 molH2(g)反应生成1 molCO(g)和1mol H2O(g)要放出41 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.淀粉、纤维素、油脂均属于高分子化合物
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.蛋白质水解的最终产物是多肽
D.石油的催化裂化主要是为了提高从石油得到的汽油等轻质油的产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com