
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )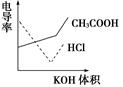

D
【解析】
试题分析:由KOH溶液滴定HCl和CH3COOH溶液的电导率变化关系图可以看出规律:①HCl被中和过程中电导率迅速下降,②CH3COOH被中和时电导率缓慢上升,③由拐点后迅速升高可推知强酸或强碱的量多少对电导率影响很大而弱酸和弱碱对电导率影响很小。根据以上三点分析NH3·H2O滴定HCl和CH3COOH混合溶液的过程为先中和HCl使电导率迅速降低,再中和CH3COOH,使电导率缓慢上升,后过量的NH3·H2O对电导率的影响很小(特别是在大量NH存在抑制NH3·H2O电离的条件下),故应选D。
考点:考查溶液的导电性、弱电解质的电离以及酸碱中和的有关判断
点评:该题是中等难度的试题,试题综合性强,贴近高考,注重答题的灵活性。该题在注重对学生基础知识巩固和检验的同时,侧重对学生能力的培养和解题方法的指导与训练,意在培养学生分析、归纳、总结问题的能力。该题的关键是明确影响溶液导电性的因素,然后结合图像灵活运用即可。


科目:高中化学 来源: 题型:
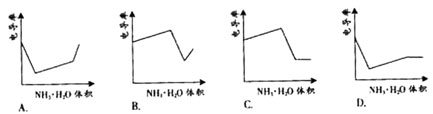
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率
变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶
液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表
示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com