
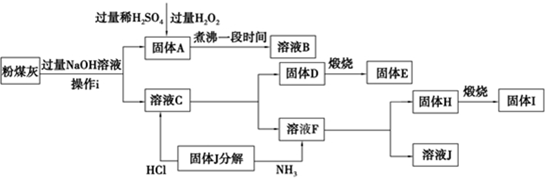
分析 粉煤灰(主要成分为SiO2、Al2O3、FeO、Fe2O3等),加入NaOH溶液使SiO2、Al2O3溶解,生成滤液C中含有Na2SiO3和NaAlO2,Fe2O3、FeO和氢氧化钠不反应,所以固体A为Fe2O3、FeO混合物,过滤后,A中加双氧水和硫酸,双氧水能氧化亚铁离子,得溶液B为Fe2(SO4)3溶液,滤液中通入过量盐酸,得固体D为H2SiO3,溶液F为氯化铝溶液,D煅烧得E为SiO2,F溶液中通入氨气得H为氢氧化铝和溶液J为氯化铵,H煅烧得I为Al2O3,据此答题.
(1)分离固体和液体用过滤操作;
(2)增大反应速率可以升高温度,增大接触面积,增大浓度等;
(3)过氧化氢氧化亚铁离子为铁离子;
(4)参与反应,过程中又生成的物质可以循环使用;
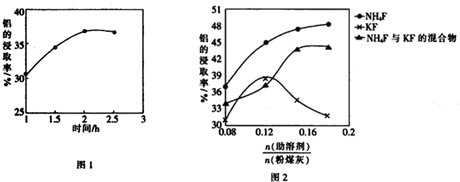
(5)根据图1可知,2h时铝的浸出率达到最大值,所以适宜的浸取时间为2h,根据图2可知,当时,NH4F助溶剂对铝的浸出率最高;
(6)根据电池总反应可知,AgO为电池正极材料,电池工作时,AgO得到电子生成Ag,其电极反应为:AgO+2e-+H2O=Ag+2OH-,有6mol电子转移,则正极生成6molOH-,负极电极反应为:Al-3e-+4OH-=[Al(OH)4]-,负极消耗8molOH-,据此分析计算.
解答 解:粉煤灰(主要成分为SiO2、Al2O3、FeO、Fe2O3等),加入NaOH溶液使SiO2、Al2O3溶解,生成滤液C中含有Na2SiO3和NaAlO2,Fe2O3、FeO和氢氧化钠不反应,所以固体A为Fe2O3、FeO混合物,过滤后,A中加双氧水和硫酸,双氧水能氧化亚铁离子,得溶液B为Fe2(SO4)3溶液,滤液中通入过量盐酸,得固体D为H2SiO3,溶液F为氯化铝溶液,D煅烧得E为SiO2,F溶液中通入氨气得H为氢氧化铝和溶液J为氯化铵,H煅烧得I为Al2O3,
(1)加入过量NaOH溶液后,只有FeO、Fe2O3不反应,SiO2与Al2O3转化为可溶性的Na2SiO3和NaAlO2,通过过滤实现FeO、Fe2O3分离,所以操作i的名称为过滤,
故答案为:过滤;
(2)根据影响化学反应速率的因素分析,可采取如升温、增加NaOH溶液浓度、将粉煤灰研磨粉碎等措施,
故答案为:升温、增加NaOH溶液浓度、将粉煤灰研磨粉碎等;
(3)固体A为FeO、Fe2O3,首先FeO和Fe2O3溶解在稀硫酸中生成FeSO4、Fe2(SO4)3,Fe2+被H2O2氧化生成Fe3+:H2O2+2H++2Fe2+=2Fe3++2H2O,
故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;
(4)根据流程图可知,NH4Cl为可循环利用物质,故答案为:NH4Cl;
(5)根据图1可知,2h时铝的浸出率达到最大值,所以适宜的浸取时间为2h,根据图2可知,当时,NH4F助溶剂对铝的浸出率最高,
故答案为:2; NH4F;
(6)根据电池总反应可知,AgO为电池正极材料,电池工作时,AgO得到电子生成Ag,其电极反应为:AgO+2e-+H2O=Ag+2OH-,有6mol电子转移,则正极生成6molOH-,负极电极反应为:Al-3e-+4OH-=[Al(OH)4]-,负极消耗8molOH-,由于正极产生的6molOH-向着负极迁移,所以电池最终消耗2molOH-,也可根据电池总反应得出消耗2molOH-,
故答案为:AgO+2e-+H2O=Ag+2OH-; 2.
点评 本题考查物质的分离、提纯的综合实验设计,为高考常见题型,侧重化学反应基本原理、物质的性质等在化学与技术中的综合应用的考查,解题关键在于找准中间产品和相互交叉的流水生产线,在分析过程中,抓住中间产品的关联作用,逐一破解,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器从表中选出正确选项( ) | 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(+283.0)kJ•mol-1 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
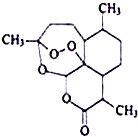 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素易溶于苯,难溶于水 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素的同分异构体不可能有芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③中氧化产物分别是FeCl2、Fe3+、Cl2 | |
| B. | 根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+ | |
| C. | 在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 | |
| D. | 根据反应①②一定可以推理得到Cl2+FeBr2═FeCl2+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡时v(正)>v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com