
 硫酸工业的生产工艺流程可简略表示如下:
硫酸工业的生产工艺流程可简略表示如下: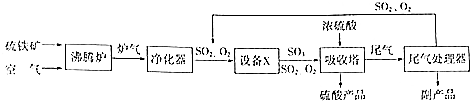 请回答下列问题:
请回答下列问题:分析 (1)根据硫酸工业制备流程,判断设备名称等;
(2)结合实际分析增大SO2平衡转化率的外界条件;
(3)A.硫铁矿中铁的氧化需要消耗O2;
B.原料选择与SO2的转化率无关;
C.用硫铁矿为原料产生的废渣较多,但废气量相同;
D.用SO2制取SO3的过程中都需要使用催化剂;
(4)A.橡胶硫化所用到的为单质硫;
B.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C.铅蓄电池中需要用到硫酸和硫酸铅;
D.过磷酸钙的制取过程中需要浓硫酸和磷矿石;
(5)二氧化硫是酸性氧化物,可用碱性物质氨水来处理.
解答 解:(1)根据所给的工艺流程可知,设备X中SO2与O2反应制备SO3,则设备X为接触室;SO2与O2反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大浓硫酸与SO3的接触面,有利于SO3的吸收,
故答案为:接触室;热交换器; 使浓硫酸与SO3充分接触;
(2)根据所给的SO2平衡转化率与温度及压强关系图可知,升高温度或减小压强平衡均向逆反应方向移动,即SO2平衡转化率减小,从理论上分析制备硫酸应采用低温高压,但实际生产中却采用了常压、450℃,这是因为在常压下SO2平衡转化率已经很高,若增大压强会增加设备成本,而温度过低反应速率较低,450℃时所使用的催化剂活性较高,综合上述因素,选择A点,即常压、450℃条件下,
故答案为:不选B点,因为压强越大对设备的投资大,消耗的动能大;SO2的转化率在1个大气压下已达97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压;不选C点,因为温度越低,SO2转化率虽然更高,但催化剂的催化作用受影响,450℃时,催化剂的催化效率最高,所以选择A点,不选C点;
(3)A.硫铁矿中Fe元素的氧化也需要消耗O2,所以硫磺生产硫酸的工艺中耗氧量减少,故A正确;
B.SO2的转化率与,故B错误;
C.用硫铁矿为原料产生的废渣较多,但废气量相同,故C错误;
D.用SO2制取SO3的过程中都需要使用催化剂,故D错误,
故答案为:A;
(4)A.橡胶硫化所用到的为单质硫,不是硫酸,故A错误;
B.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,用到浓硫酸,故B正确;
C.铅蓄电池中需要用到硫酸和硫酸铅,会用到硫酸,故C正确;
D.过磷酸钙的制取过程中需要浓硫酸和磷矿石,故D正确;
故答案为:BCD;
(5)用氨-酸法进行尾气脱硫,则需要将尾气中的SO2吸收,SO2可与氨水反应,但反应生成的亚硫酸铵(或亚硫酸氢铵)不稳定,需要进一步转化为稳定的硫酸铵,发生反应的方程式有:+NH3+H2O=NH4HSO3或SO2+2NH3+H2O=(NH4)2SO3 2NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2↑或(NH4)2SO3+H2SO4=(NH4)2SO4+H2O+SO2↑,
故答案为:SO2+NH3+H2O=NH4HSO3或SO2+2NH3+H2O=(NH4)2SO3 2NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2↑或(NH4)2SO3+H2SO4=(NH4)2SO4+H2O+SO2↑.
点评 本题是对化学与技术及工业生产的考查,需要学生细读生产工艺图中各物质的变化进行解答,把握氨碱法、制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质 | |
| B. | Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐 | |
| C. | 二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应 | |
| D. | 氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 种 | B. | 6 种 | C. | 5 种 | D. | 4 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
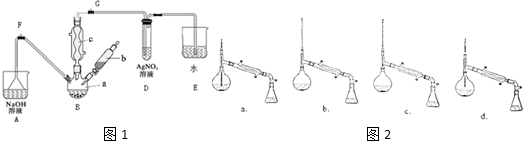
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
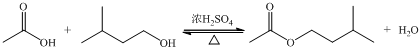
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
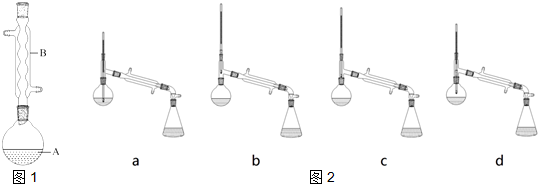
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,v正(O2)=v逆(O2)=0必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 在同一段时间范围内,用上述四种物质NH3、O2、NO、H2O的变化表示正反应速率的数值中,v正(H2O)最大 | |
| D. | 若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,消耗1molSO2的同时消耗1molSO3 | |
| C. | 如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用X表示此反应的反应速率是0.1amol•L-1•min-1 | |
| B. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 | |
| C. | 向平衡后的体系中加入1 mol M,平衡向逆反应方向移动 | |
| D. | 向上述平衡体系中再充入1 mol X,v正增大,v逆减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
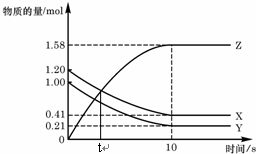 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )| A. | t秒时该反应达到化学平衡状态 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?2Z(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com