
A、用铂作电极电解MgCl2溶液:2Cl-+2H2O
| ||||
B、用石墨电极电解氯化铜溶液:Cu2++2Cl-+2H2O
| ||||
C、向Ca(HCO3)2溶液中滴加少量的NaOH溶液:Ca2++HC
| ||||
| D、将少量氯气通入溴化亚铁溶液中:2Br-+Cl2═Br2+2Cl- |
| ||
| ||


科目:高中化学 来源: 题型:
 研究CO、NO2、SO2等大气污染气体的处理具有重要意义.
研究CO、NO2、SO2等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干电池的负极是锌筒 |
| B、MnO2在碳棒上发生还原反应 |
| C、闲置时间过长干电池也会失去供电能力 |
| D、工作时电解液中的NH4+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的KI溶液:Na+、Ag+、NO3-、SO42- |
| B、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| C、0.1 mol?L-1的KMnO4溶液:Na+、K+、Cl-、SO32- |
| D、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g氢气所含原子数是NA |
| B、17g NH3所含的电子数是10NA |
| C、NA个氧分子和NA个氢分子的质量比等于1:1 |
| D、2.3g金属钠全部变成钠离子时失去的电子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只要是氧化还原反应就可以将其设计成原电池 |
| B、在铜、锌和硫酸构成的原电池中加入少量过氧化氢可以加快速率 |
| C、精炼铜时,阴极析出铜的质量比阳极溶解的铜大 |
| D、在相同条件下,用排水法收集电解饱和食盐水产生的气体时,收集到的气体体积阴极大于阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的两个实验装置,溶液的体积均为200mL.开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液和体积变化,下列叙述中正确的是( )
如图所示的两个实验装置,溶液的体积均为200mL.开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液和体积变化,下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①减小,②增大 |
| C、电极上生成物质的质量:①=② |
| D、电极反应式:①中阳极2Cl--2e-═Cl2↑,②中负极2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
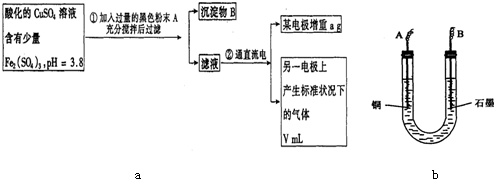
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com