
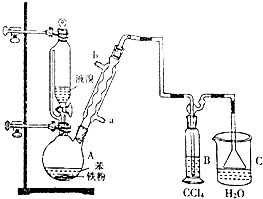
 .
.分析 根据实验装置图可知,在装置A中用苯与溴在铁粉作催化剂的条件下生成溴苯和溴化氢,由于苯和液溴都是易挥发的物质,为了提高原料的利用率,用球形冷凝管进行冷凝回流,生成的溴化氢气体中含有少量的溴蒸,用B装置中的四氯化碳除去溴化氢中的溴蒸汽,在装置C中用水吸收生成的溴 化氢,由于溴化氢极易溶于水,所以在用水吸收溴化氢的时候用防倒吸装置.
(1)A中用苯与溴在铁粉作催化剂的条件下生成溴苯和溴化氢;
(2)该反应为放热反应,苯和液溴均易挥发,溴蒸气是一种红棕色的气体,据此分析解答;
(3)采用冷凝管的作用是将挥发出的反应物蒸气冷凝使其回流到反应容器中;冷凝水的水流方向和气流方向相反,逆流冷凝效果好,需下口进,上口出;溴极易溶于四氯化碳,
B中盛放的CCl4的作用是除去溴化氢气体中的溴蒸气;
(4)根据上面的分析可知,C中是用水吸收的溴化氢,能与硝酸银溶液反应生成浅黄色沉淀,溴化氢溶液呈酸性能使石蕊试纸变红;
(5)得到粗溴苯中含有苯、溴、溴化铁等杂质,要先用水洗除溴化铁,再用碱洗除溴,再水洗除碱等,再干燥、蒸馏除苯,据此答题.
解答 解:(1)A中用苯与溴在铁粉作催化剂的条件下反应,苯环上的一个氢原子被一个溴原子取代,其反应方程式为: ,
,
故答案为: ;
;
(2)由于反应放热,反应液微沸,苯和液溴均易挥发,溴蒸气是一种红棕色的气体,有红棕色气体充满A容器,
故答案为:反应液微沸;有红棕色气体充满A容器;
(3)溴与苯发生取代反应生成溴苯与溴化氢,反应放热,冷凝管的作用是冷凝挥发出来的苯和液溴,并使它们流回到烧瓶中,冷凝水的水流方向和气流方向相反,下口进,上口出,所以加热A前,需先从“a”口通入水,克服水的重力充满冷凝管,与气体逆流,冷凝效果好,根据相似相溶原理,溴极易溶于四氯化碳,而溴化氢则不溶,所以C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气,
故答案为:冷凝回流;a;除去溴化氢气体中的溴蒸气;
(4)证明苯和液溴发生的是取代反应而不是加成反应,即证明有溴化氢产生即可,所以加入硝酸银溶液后溶液中有浅黄色沉淀产生,或者用蓝色石蕊试纸检验溴化氢的存在,
故答案为:有淡黄色沉淀生成;蓝色石蕊;
(5)得到粗溴苯中含有苯、溴、溴化铁等杂质,要先用水洗除溴化铁,再用碱洗除溴,再水洗除碱等,再干燥、蒸馏除苯,所以实验的正确的操作顺序是②④②③①,
故答案为:b.
点评 本题考查有机物实验制备,涉及溴苯的制取,侧重考查学生对装置与原理的分析评价,明确各个装置的作用及基本操作方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 乙烯使溴水褪色 | |
| C. | 点燃乙烯出现黑烟 | |
| D. | 甲烷与氯气的混合气体,光照一段时间后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含20.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| B. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则标况下1mol氢气完全燃烧放出241.8 kJ的热量 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=b kJ•mol-1,则a>b | |
| D. | 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
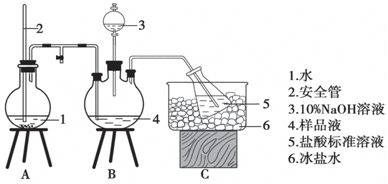 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.3410-6 | 7.110-7 | 1.110-8 | 6.510-5 | 1.010-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
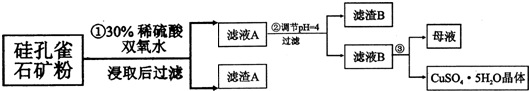
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com