
加热N2O5,依次发生的分解反应为①N2O5 N2O3+O2,②N2O3
N2O3+O2,②N2O3 N2O+O2;在2 L密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则t ℃时反应①的平衡常数为( )
N2O+O2;在2 L密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则t ℃时反应①的平衡常数为( )
A.10.7 B.8.5 C.9.6 D.10.2
.B 解析:题设中有两个反应,可理解为先发生反应①,其中生成的N2O3有一部分再发生分解反应②,且在两个反应中都有O2生成,再由已知条件列方程组求解。
设反应①中生成N2O3物质的量浓度为x, 反应②中生成N2O物质的量浓度为y。则:
反应②中生成N2O物质的量浓度为y。则:
N2 O5(g)
O5(g) N2O3(g)+O2(g)
N2O3(g)+O2(g)
起始浓度/(mol·L-1)4 0 0
转化浓度/(mol·L-1)x x x
N2O3(g) N2O(g)+O2(g)
N2O(g)+O2(g)
起始浓度/(mol·L-1)x 0 0
转化浓度/(mol·L-1)y y y
平衡浓度/(mol·L-1)x-y y y
依题意O2的平衡浓度为x+y=4.5 mol·L-1
N2O3的平衡浓度为x-y=1.7 mol·L-1
解得x=3.1 mol·L-1
y=1.4 mol·L-1
N2O5的平衡浓度为4 mol·L-1-3.1 mol·L-1=0.9 mol·L-1
N2O的平衡浓度为1.4 mol·L-1
则反应①平衡常数K==8.5


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
下列各组化合物中,不论二者以什么比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水的质量不变的是( )
A.CH4、C2H6 B.C2H6、C3H6
C.C2H4、C3H6 D.C3H4、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量CO2气体通入水玻璃中,然后蒸干,再在高温下充分燃烧,最后所得固体物质是
A. Na2SiO3 B. Na2CO3、Na2SiO3 C. Na2CO3、 SiO2 D. SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
液态化合物AB会发生微弱的自身电离,电离方程式为ABA++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A.c(A+)随温度升高而降低
B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25 ℃)>(35 ℃)
D.AB的电离是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是_____________________________________________________。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是________。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________。反应所需时间的长短关系是_______________________________ _________________________________________。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示的一些物质或概念间的从属关系中不正确的是( )
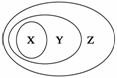
| X | Y | Z | |
| A | 酸 | 化合物 | 纯净物 |
| B | 电解质 | 盐 | 化合物 |
| C | 胶体 | 分散系 | 物质 |
| D | 碱性氧化物 | 氧化物 | 化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
煤是一种重要的能源,含有硫元素,燃烧时会生成SO2。下列说法正确的是
( )。
A.煤是含硫化合物
B.煤是一种可再生能源
C.在水吸收SO2的过程中只发生物理变化
D.SO2是酸性氧化物,被云雾吸收后可转化成酸雨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com