
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①④ |
科目:高中化学 来源: 题型:实验题
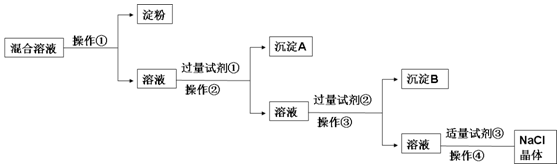
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
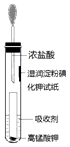 氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D. | 4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
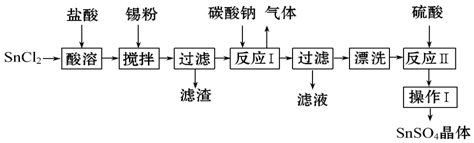
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═2Al3++3SO42- | B. | FeCl2═Fe2++3Cl- | ||
| C. | H2SO4═H2++SO42- | D. | Ca(OH)2═Ca2++2(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 逆反应速率増大,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 逆反应速率减小,正反应速率増大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
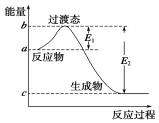 W是由A、B两种元素组成的AB2型化合物.
W是由A、B两种元素组成的AB2型化合物.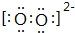 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com