
| A. | 向样品溶液中逐渐加入少量锌粉,开始时未见产生气泡,样品溶液中一定不存在稀硫酸 | |
| B. | 向样品溶液中加入一定质量的铁粉后,充分反应后,有残余固体且质量比原加入的铁粉多,样品溶液中一定含有硫酸铜 | |
| C. | 向样品溶液中加入铜片,铜片溶解,溶液中一定含有硫酸铁 | |
| D. | 向样品溶液中逐滴滴入氢氧化钠,当滴入一定量后才观察到有浑浊现象,则样品溶液中一定含有稀硫酸 |
分析 含硫酸铜的溶液是蓝色溶液,含硫酸铁的溶液是棕黄色溶液,稀硫酸是无色溶液,据此分析解题;
解答 解:A.如果是含有稀硫酸和硫酸铜或硫酸铁的混合溶液,向样品溶液中逐渐加入少量锌粉,因Fe3+和Cu2+的氧化性均强于H+,刚开始时因还原Fe3+或Cu2+不会产生气泡,然后有气泡,则样品溶液中一定不存在稀硫酸的说法错误,故A错误;
B.如果溶液里混有硫酸铜,向样品溶液中加入一定质量的铁粉后,因有铜置换出来,充分反应后,残余固体质量才可能比原加入的铁粉多,故B正确;
C.因只有Fe3+的溶液能溶解铜,故C正确;
D.向样品溶液中逐滴滴入氢氧化钠,当滴入一定量后才观察到有浑浊现象,说明最先发生的是酸碱中和,则样品溶液中一定含有稀硫酸,故D正确;
故选:A.
点评 本题主要考查的是氧化还原反应的先后规律的应用,属基础性考查,难度不大,但对学生分析问题、解决问题的能力要求较高,正确分析题意是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 烧杯中固体有铁、无铜 | B. | 烧杯中固体有铜、无铁 | ||
| C. | 烧杯中固体铁、铜都有 | D. | 烧杯中固体铁、铜都无 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:C12+H2O?H++C1-+HClO | |
| B. | 向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3+CaCO3↓+2H2O | |
| C. | 将适量的CO2通入Ca(C1O)2溶液中:Ca2++2C1O-+CO2+H2O═2HC1O+CaCO3↓ | |
| D. | Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | Al3+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠可用作漂白剂 | B. | 明矾可用作净水剂 | ||
| C. | 碳酸氢钠可用于治疗胃酸过多 | D. | 氧化铝可用来制造耐火坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
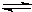 Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
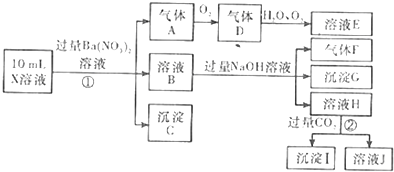
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com