

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
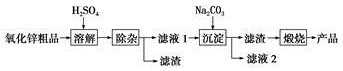
分析 以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线为:在酸溶①步骤中,硫酸溶液中加入二氧化锰、硫化铜,发生氧化还原反应生成硫单质,二氧化锰被还原为二价锰离子留在溶液中;然后在除锰步骤中,二价锰离子转化为碳酸锰沉淀,溶液中CuSO4转变为[Cu(NH3)4]CO3留在溶液中,然后[Cu(NH3)4]CO3发生分解反应得到CuO固体、氨气与二氧化碳,再用硫酸溶解CuO得到CuSO4,氯化钠、亚硫酸钠、硫酸铜反应生成氯化亚铜和硫酸钠和硫酸,再经过过滤、洗涤、干燥得到氯化亚铜,以此解答该题.
解答 解:(1)反应的方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,且二氧化锰在酸性条件下氧化亚铁离子,
故答案为:S和Fe;CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O;
(2)步骤③目的是除去铁离子,以生成Fe(OH)3,应调节pH为3.7≤pH<4.7,以避免生成氢氧化铜,故答案为:3.7≤pH<4.7;Fe(OH)3;
(3)可用KSN检验铁离子,方法是取少量最后一次的洗涤过滤液于试管中,向其中滴加KSCN溶液(BaCl2溶液),若溶液不显红色(无白色沉淀),则表明已洗涤完全,
故答案为:取少量最后一次的洗涤过滤液于试管中,向其中滴加KSCN溶液(BaCl2溶液),若溶液不显红色(无白色沉淀),则表明已洗涤完全;
(4)6CuCl~6Fe2+~Cr2O72-
n(CuCl)=6×0.1000mol•L-1×25.00mL×10-3L•mL-1
=1.500×10-2mol,
m(CuCl)=99.5g•mol-1×1.500×10-2mol=1.493g,
w(CuCl)=$\frac{1.493g}{1.600g}×100%$=93.3%,
故答案为:93.3%.
点评 本题考查物质制备实验、对工艺流程分析评价、条件的控制、物质的分离提纯等,理解工艺流程原理是解题关键,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 32g/mol | B. | 165g/mol | C. | 55g/mol | D. | 100g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①和②互为同分异构体,①和④互为同系物 | |
| B. | ④的一氯代物有三种 | |
| C. | ②不可能由烯烃与氢气加成而获得 | |
| D. | 能通过加氢反应得到③的炔烃有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -332 | B. | +130 | C. | +332 | D. | -l30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中可能含有K+ | |
| B. | 该溶液中肯定含有NH4+、SO42-、AlO2-、NO3- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含K+,且c(K+)≥0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 常温常压下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com