
 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、金属的电化学腐蚀比化学腐蚀更普遍 |
| B、钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-═4OH- |
| C、钢铁在干燥空气中不易被腐蚀 |
| D、用牺牲锌块的方法来保护船身 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
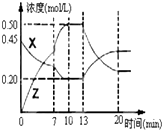 Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,
Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
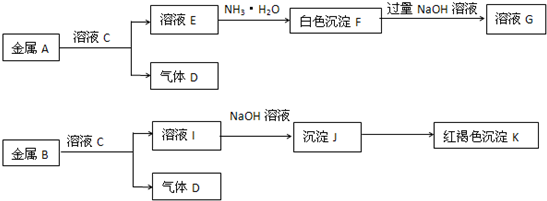
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )| A、原子半径:Z<W<Y<X |
| B、元素Y的氧化物能与NaOH溶液反应 |
| C、最简单气态氢化物的热稳定性:Y<X |
| D、W、Z的氧化物都能与碱反应生成盐和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com