
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ?????????? ,下列可作阴极材料的是________________。
A.铝材 ????????? B.石墨 ????????? C.铅板 ?????????? D.纯铝
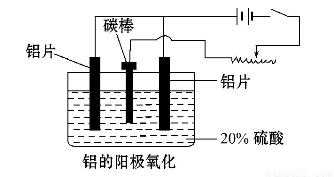
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是____________?????????????? 。
(5)下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
(1)降低Al2O3熔点?? (2分)
(2)Al- 3e-=? Al3+(2分)?? D(2分)
(3)2 Al- 6e-+ 3H2O = Al2O3 + 6H+(2分)
(4)铝阳极表面不断生成氧化物,电阻增大,为了保持稳定的电流,需要不断增大电压。(3分)
(5)B、D(4分)
【解析】
试题分析:(1)氧化铝熔点较高,电解时能耗大,加入冰晶石可以降低Al2O3熔化的温度,减少能耗; (2)结合课本所学电解粗铜制精铜,粗铜作阳极、精铜作阴极可知:粗铝作阳极发生氧化反应,电极方程式为;Al- 3e-=? Al3+,纯铝作阴极,选择D答案;(3)铝在阳极发生氧化反应形成氧化铝,电极反应为:2Al- 6e-+ 3H2O = Al2O3 + 6H+;(4)铝阳极表面不断生成氧化物,电阻增大,为了保持稳定的电流,需要不断增大电压。(5)B、D
考点:考查电化学原理、电极方程式的书写。


科目:高中化学 来源:2015届吉林省高二上学期期末考试化学试卷(解析版) 题型:填空题
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑
4Al+3O2↑
加入冰晶石的作用:________________________________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________________,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
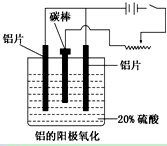
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_____________________________________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(5)下列说法正确的是__________________。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com