
ЁОЬтФПЁПЖОжиЪЏЕФжївЊГЩЗжBaCO3ЃЈКЌCa2+ЁЂMg2+ЁЂFe3+ЕШдгжЪЃЉЃЌЪЕбщЪвРћгУЖОжиЪЏжЦБИBaCl22H2OЕФСїГЬШчЯТЃК
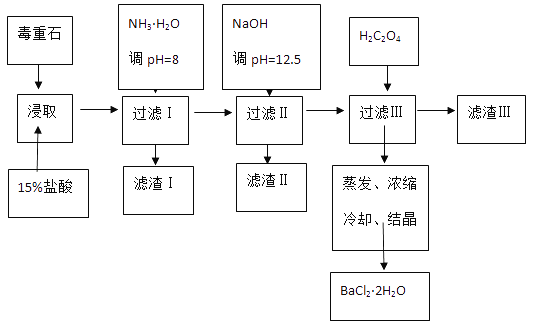
ЃЈ1ЃЉЪЕбщЪвгУ37%ЕФбЮЫсХфжУ15%ЕФбЮЫсЃЌГ§СПЭВЭтЛЙашЪЙгУЯТСавЧЦїжаЕФ_________ЁЃ
a.ЩеБ b.ШнСПЦП c.ВЃСЇАє d.ЕЮЖЈЙм
ЃЈ2ЃЉМгШыNH3H2OЕїНкpH=8ПЩГ§ШЅ_______ЃЈЬюРызгЗћКХЃЉЃЌТЫдќЂђжаКЌ________ЃЈЬюЛЏбЇЪНЃЉЁЃМгШыH2C2O4ЪБгІБмУтЙ§СПЃЌдвђЪЧ___________ЁЃ
Ca2+ | Mg2+ | Fe3+ | |
ПЊЪМГСЕэЪБЕФpH | 11.9 | 9.1 | 1.9 |
ЭъШЋГСЕэЪБЕФpH | 13.9 | 11.1 | 3.2 |
ЯђBaC2O4аќзЧвКжаМгШыCaCl2ЃЌПЩЗЂЩњГСЕэЕФВПЗжзЊЛЏЃЌЧыаДГіЗДгІЙ§ГЬжаЕФРызгЗНГЬЪН___________________ЃЌМЦЫуИУЗДгІЕФЦНКтГЃЪ§K=___________ЃЈKspЃЈBaC2O4ЃЉ=1.6ЁС10-7ЃЌKspЃЈCaC2O4ЃЉ=2.3ЁС10-9ЃЌБЃСєвЛЮЛаЁЪ§ЃЉ
ЃЈ3ЃЉРћгУМфНгЫсМюЕЮЖЈЗЈПЩВтЖЈBa2+ЕФКЌСПЃЌЪЕбщЗжСНВННјааЁЃвбжЊЃК2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4Ё§
ВНжшЂёЃКвЦЖЏx mLвЛЖЈХЈЖШЕФNa2CrO4ШмвКгкзЖаЮЦПжаЃЌМгШыЫсМюжИЪОМСЃЌгУb molL-1бЮЫсБъзМвКЕЮЖЈжСжеЕуЃЌВтЕУЕЮМгбЮЫсЬхЛ§ЮЊV0mLЁЃ
ВНжшЂђЃКвЦШЁy mL BaCl2ШмвКгкзЖаЮЦПжаЃЌМгШыx mLгыВНжшЂёЯрЭЌХЈЖШЕФNa2CrO4ШмвКЃЌД§Ba2+ЭъШЋГСЕэКѓЃЌдйМгШыЫсМюжИЪОМСЃЌгУb molL-1бЮЫсБъзМвКЕЮЖЈжСжеЕуЃЌВтЕУЕЮМгбЮЫсЕФЬхЛ§ЮЊV1mLЁЃИљОнЩЯЪіЪ§ОнЃЌПЩМЦЫуГіBaCl2ШмвКХЈЖШЮЊ_________molL-1ЃЈгУКЌзжФИЕФЪНзгБэЪОЃЉЁЃШєВНжшЂђжаЕЮМгбЮЫсЪБгаЩйСПД§ВтвКНІГіЃЌдђBa2+ХЈЖШЕФВтСПжЕНЋ_______ЃЈЬюЁАЦЋДѓЁБЛђЁАЦЋаЁЁБЃЉЁЃ
ЁОД№АИЁП ac Fe3+ MgЃЈOHЃЉ2ЁЂCaЃЈOHЃЉ2 H2C2O4Й§СПЛсЕМжТЩњГЩBaC2O4ГСЕэЃЌВњЦЗЕФВњСПМѕЩй BaC2O4+Ca2+= CaC2O4+Ba2+ 69.6 ![]() ЦЋДѓ
ЦЋДѓ
ЁОНтЮіЁП(1)ШмвКЕФжЪСПЗжЪ§= ЁС100%ЃЌЪЕбщЪвгУ37%ЕФбЮЫсХфжУ15%ЕФбЮЫсЃЌашМЦЫуГіХЈбЮЫсЕФЬхЛ§КЭЫЎЕФЬхЛ§ЃЌашгУСПЭВСПШЁЃЌХЈбЮЫсЯЁЪЭЮЊЯЁбЮЫсЃЌашгУЩеБзїЮЊШнЦїЯЁЪЭбЁдёaЃЌВЃСЇАєНСАшМгЫйШмНтбЁдёcЃЌЙЪД№АИЮЊЃКacЃЛ
ЁС100%ЃЌЪЕбщЪвгУ37%ЕФбЮЫсХфжУ15%ЕФбЮЫсЃЌашМЦЫуГіХЈбЮЫсЕФЬхЛ§КЭЫЎЕФЬхЛ§ЃЌашгУСПЭВСПШЁЃЌХЈбЮЫсЯЁЪЭЮЊЯЁбЮЫсЃЌашгУЩеБзїЮЊШнЦїЯЁЪЭбЁдёaЃЌВЃСЇАєНСАшМгЫйШмНтбЁдёcЃЌЙЪД№АИЮЊЃКacЃЛ
(2)ИљОнСїГЬЭМКЭБэжаЪ§ОнПЩжЊЃКFe3+ЭъШЋГСЕэЪБЕФpHЮЊ3.2ЃЌМгШыАБЫЎЃЌЕїpHЮЊ8ЃЌFe3++3NH3H2O=Fe(OH)3Ё§+3NH4+ЃЌFe3+ЭъШЋГСЕэЃЌТЫдќIЮЊFe(OH)3ЃЌМгШыЧтбѕЛЏФЦЕїНкpH=12.5ЃЌCa2+ЭъШЋГСЕэЪБЕФpHЮЊ13.9ЃЌMg2+ЭъШЋГСЕэЪБЕФpHЮЊ11.1ЃЌMg2+ЭъШЋГСЕэЃЌCa2+ВПЗжГСЕэЃЌТЫдќЂђжаКЌMg(OH)2ЁЂCa(OH)2ЃЌШмвКжажївЊКЌCa2+ЁЂBa2+ЃЌKsp(BaC2O4)=1.6ЁС10-7ЃЌKsp(CaC2O4)=2.3ЁС10-9ЃЌвзаЮГЩCaC2O4ГСЕэЃЌМгШыH2C2O4ЪБгІБмУтЙ§СПЃЌЗРжЙCaC2O4ГСЕэЭъШЋКѓЃЌЙ§СПЕФH2C2O4ЛсЕМжТЩњГЩBaC2O4ГСЕэЃЌВњЦЗЕФВњСПМѕЩйЃЌЯђBaC2O4аќзЧвКжаМгШыCaCl2ЃЌПЩЗЂЩњГСЕэЕФВПЗжзЊЛЏЃЌЗДгІЙ§ГЬжаЕФРызгЗНГЬЪНЮЊBaC2O4+Ca2+= CaC2O4+Ba2+ЃЌЗДгІЕФЦНКтГЃЪ§K=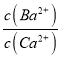 =
=![]() =
=![]() =69.6ЃЌЙЪД№АИЮЊЃКFe3+ЃЛMg(OH)2ЁЂCa(OH)2ЃЛH2C2O4Й§СПЛсЕМжТЩњГЩBaC2O4ГСЕэЃЌВњЦЗЕФВњСПМѕЩйЃЛBaC2O4+Ca2+= CaC2O4+Ba2+ЃЛ69.6ЃЛ
=69.6ЃЌЙЪД№АИЮЊЃКFe3+ЃЛMg(OH)2ЁЂCa(OH)2ЃЛH2C2O4Й§СПЛсЕМжТЩњГЩBaC2O4ГСЕэЃЌВњЦЗЕФВњСПМѕЩйЃЛBaC2O4+Ca2+= CaC2O4+Ba2+ЃЛ69.6ЃЛ
(3)ВНжшЂђЃКД§Ba2+ЭъШЋГСЕэКѓЃЌдйМгШыЫсМюжИЪОМСЃЌгУb molL-1бЮЫсБъзМвКЕЮЖЈжСжеЕуЃЌВтЕУЕЮМгбЮЫсЕФЬхЛ§ЮЊV1mLЃЌдђЗЂЩњ2CrO42-+2H+ЈTCr2O72-+H20 ЕФбЮЫсЕФЮяжЪЕФСПЮЊЃКV1ЁС10-3ЁСbmolЃЌВНжшЂёЃКгУb molL-1бЮЫсБъзМвКЕЮЖЈжСжеЕуЃЌВтЕУЕЮМгбЮЫсЬхЛ§ЮЊV0mLЃЌМгШыЕФзмбЮЫсЕФЮяжЪЕФСПЃКV0ЁС10-3ЁСbmolЃЌBa2++CrO42-ЈTBaCrO4Ё§ЃЌгыBa2+ЗДгІЕФCrO42-ЕФЮяжЪЕФСПЮЊV0ЁС10-3ЁСbmol-V1ЁС10-3ЁСbmol=(V0-V1)bЁС10-3molЃЌВНжшЂђЃКвЦШЁy mLBaCl2ШмвКгкзЖаЮЦПжаЃЌЫљвдBaCl2ШмвКЕФХЈЖШЮЊЃК ![]() mol/L=
mol/L=![]() mol/LЃЌШєВНжшЂђжаЕЮМгбЮЫсЪБгаЩйСПД§ВтвКНІГіЃЌV1МѕаЁЃЌдђBa2+ХЈЖШВтСПжЕНЋЦЋДѓЃЌЙЪД№АИЮЊЃК
mol/LЃЌШєВНжшЂђжаЕЮМгбЮЫсЪБгаЩйСПД§ВтвКНІГіЃЌV1МѕаЁЃЌдђBa2+ХЈЖШВтСПжЕНЋЦЋДѓЃЌЙЪД№АИЮЊЃК ![]() ЃЛЦЋДѓЁЃ
ЃЛЦЋДѓЁЃ


 ЖсЙкбЕСЗЕЅдЊЦкФЉГхДЬ100ЗжЯЕСаД№АИ
ЖсЙкбЕСЗЕЅдЊЦкФЉГхДЬ100ЗжЯЕСаД№АИ аТЫМЮЌаЁЙкОќ100ЗжзївЕБОЯЕСаД№АИ
аТЫМЮЌаЁЙкОќ100ЗжзївЕБОЯЕСаД№АИ УћЪІжИЕМвЛОэЭЈЯЕСаД№АИ
УћЪІжИЕМвЛОэЭЈЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП[ЛЏбЇЁЊЁЊбЁао5ЃКгаЛњЛЏбЇЛљДЁ]
гаЛњЮяFЪЧгаЛњКЯГЩЙЄвЕжавЛжжживЊЕФжаМфЬхЁЃвдМзБНКЭБћЯЉЮЊЦ№ЪМдСЯКЯГЩFЕФЙЄвеСїГЬШчЯТЃК

ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЛЏКЯЮяBжаКЌбѕЙйФмЭХУћГЦЪЧ_________FЕФНсЙЙМђЪН__________________
ЃЈ2ЃЉаДГіCгывјАБШмвКЙВШШЕФЛЏбЇЗДгІЗНГЬЪНЃК_______________________
ЃЈ3ЃЉЛЏКЯЮяDВЛФмЗЂЩњЕФЗДгІга__________________ЃЈЬюађКХЃЉЁЃ
ЂйМгГЩЗДгІЂкШЁДњЗДгІЂлЯћШЅЗДгІЂмбѕЛЏЗДгІЂнЫЎНтЗДгІ
ЃЈ4ЃЉBЕФКЌБНЛЗНсЙЙЕФЭЌЗжвьЙЙЬхЛЙга__________жжЃЌЦфжавЛжжЕФКЫДХЙВеёЧтЦзжаГіЯж4ИіЗхЧвВЛгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЕФЪЧ____________ЃЈЬюНсЙЙМђЪНЃЉЁЃ
ЃЈ5ЃЉBгыDЗЂЩњЗДгІЕФРраЭ________________________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжаЛЊЮФЛЏдДдЖСїГЄЁЂВЉДѓОЋЩюЁЃДгЛЏбЇЕФЪгНЧПД,ЯТСаРэНтДэЮѓЕФЪЧЃЈ ЃЉ
A | B | C | D | |
жаЛЊ ЮФЛЏ | ЁАЧЇЬдЭђфѕЫфаСПрЃЌДЕОЁПёЩГЪМЕНН№ЁБ--СѕгэЮ§ЁЖРЫЬЮЩГЁЗ | ЁЖЬьЙЄПЊЮяЁЗДИЖЭЦЊЃЈвБЬњЃЉМЧдиЃКЁАбшдЦЃЌЁЎЭђЦївдЧЏЮЊзцЁЃЁЏЗЧЮоЛќжЎЫЕвВЁЃЁБ | ГЩгяЁАЕЖИћЛ№ёё(nЈАu)ЁБ |
КюЕТАё |
ДгЛЏбЇ ЕФЪгНЧ РэНт | ЪЋОфжаЕФЁАЬдЁЂфѕЁБЯрЕБгкЗжРыЬсДПВйзїжаЕФЁАЙ§ТЫЁБ | ЁАЧЏЁБЪЧжИзїЮЊШлЬњТЏЁЂМгШШТЏЕФлслі | ЙХШЫВЅжжЧАЯШЗЅШЅЪїФОЩеЕєвАВнЃЌгУгрЛвПЩвдЗЪЬяЃЌЛЙПЩвдНЕЕЭЭСШРМюад | ЮвЙњЛЏбЇЙЄвЕЕФЕьЛљШЫ,жївЊГЩОЭ: КюЪЯжЦМюЗЈ,ИУМюжИЕФЪЧДПМю |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЙГЩдТМОКЭПзШИЕФжївЊЛЏбЇдЊЫига
A.CЁЂHЁЂOЁЂSЁЂNЁЂPB.CЁЂHЁЂOЁЂNЁЂPЁЂFe
C.NЁЂPЁЂKЁЂCaЁЂSЁЂZnD.HЁЂOЁЂKЁЂSЁЂPЁЂMg
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФђЫи[COЃЈNH2ЃЉ2]ЪЧЪзИігЩЮоЛњЮяШЫЙЄКЯГЩЕФгаЛњЮяЁЃ
ЃЈ1ЃЉЙЄвЕЩЯФђЫигЩCO2КЭNH3дквЛЖЈЬѕМўЯТКЯГЩЃЌЦфЗДгІЗНГЬЪНЮЊ_______________ЁЃ
ЃЈ2ЃЉЕБАБЬМБШ ![]() =4ЃЌЪБCO2ЕФзЊЛЏТЪЫцЪБМфЕФБфЛЏЙиЯЕШчЭМ1ЫљЪОЁЃ
=4ЃЌЪБCO2ЕФзЊЛЏТЪЫцЪБМфЕФБфЛЏЙиЯЕШчЭМ1ЫљЪОЁЃ
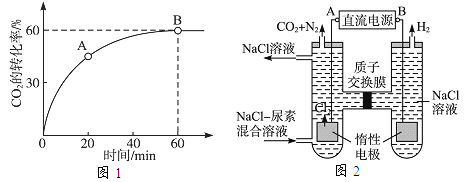
ЂйAЕуЕФФцЗДгІЫйТЪvФцЃЈCO2ЃЉ_______BЕуЕФе§ЗДгІЫйТЪvе§ЃЈCO2ЃЉЃЈЬюЁАЃМЁБЁЂЁАЃОЁБЛђЁА=ЁБЃЉЁЃ
ЂкЗДгІДяЕНЦНКтКѓЃЌNH3ЕФзЊЛЏТЪЮЊ_____________ЁЃ
ЃЈ3ЃЉШЫЙЄЩідрПЩВЩгУМфНгЕчЛЏбЇЗНЗЈГ§ШЅДњаЛВњЮяжаЕФФђЫиЃЌдРэШчЭМ2ЁЃ
ЂйЕчдДЕФИКМЋЮЊ_____ЃЈЬюЁАAЁБЛђЁАBЁБЃЉЁЃ
ЂкбєМЋЪвжаЗЂЩњЕФЕчМЋЗДгІЮЊ_________ЃЌ_________________ЁЃ
ЂлШєСНМЋЙВЪеМЏЕНЦјЬх13.44LЃЈБъзМзДПіЃЉЃЌдђГ§ШЅЕФФђЫиЮЊ________gЃЈКіТдЦјЬхЕФШмНтЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. БъзМзДПіЯТЃЌ3.4 g D2O2ЫљКЌМЋадМќЪ§ФПЮЊ0.2NA
B. 25ЁцЃЌpH =2ЕФH2SO4ШмвКжаЃЌH+ЕФЪ§ФПЮЊ0.02 NA
C. БъзМзДПіЯТЃЌ2.24 L CCl4КЌгаЕФЗжзгЪ§ФПЮЊ0.1NA
D. lmol OH-КЌгаЕФЕчзгЪ§ФПЮЊ10NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊГфЗжШМЩеa gввШВЦјЬхЪБЩњГЩ1molЖўбѕЛЏЬМЦјЬхКЭвКЬЌЫЎЃЌВЂЗХГіШШСПb kJЃЌдђввШВШМЩеЕФШШЛЏбЇЗНГЬЪНе§ШЗЕФЪЧЃЈ ЃЉ
AЃЎ2C2H2ЃЈgЃЉ+5O2ЃЈgЃЉЈT4CO2ЃЈgЃЉ+2H2OЃЈlЃЉЁїH=Љ2b kJЁЄmolЉ1
BЃЎC2H2ЃЈgЃЉ+![]() O2ЃЈgЃЉЈT2CO2ЃЈgЃЉ+H2OЃЈlЃЉЁїH=+2b kJЁЄmolЉ1
O2ЃЈgЃЉЈT2CO2ЃЈgЃЉ+H2OЃЈlЃЉЁїH=+2b kJЁЄmolЉ1
CЃЎ2C2H2ЃЈgЃЉ+5O2ЃЈgЃЉЈT4CO2ЃЈgЃЉ+2H2OЃЈlЃЉЁїH=Љ4b kJЁЄmolЉ1
DЃЎ2C2H2ЃЈgЃЉ+5O2ЃЈgЃЉЈT4CO2ЃЈgЃЉ+2H2OЃЈlЃЉЁїH=+b kJЁЄmolЉ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкБъзМзДПіЯТЃЌвЛИіГфТњCl2ЕФКуШнУмБеШнЦїЕФжЪСПЮЊ74.6 gЃЌШєИФГфТњN2ЃЌЦфжЪСПЮЊ66 gЃЌдђШнЦїЕФШнЛ§ЮЊЃК
A.5.6LB.11.2LC.2.24LD.4.48L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГШмвКжаПЩФмКЌгаЯТСа6жжРызгжаЕФФГМИжжЃКClЁЂSO42ЁЊЁЂNH4+ЁЂCO32ЁЊЁЂK+ЁЂNa+ЁЃЮЊШЗШЯШмвКзщГЩНјааШчЯТЪЕбщЃК
Ђй200 mLЩЯЪіШмвКЃЌМгШызуСПBaCl2ШмвКЃЌЗДгІКѓНЋГСЕэЙ§ТЫЁЂЯДЕгЁЂИЩдяЃЌЕУГСЕэ4.30 gЃЌЯђГСЕэжаМгШыЙ§СПЕФбЮЫсЃЌга2.33 gГСЕэВЛШмЁЃ
ЂкЯђЂйЕФТЫвКжаМгШызуСПЕФNaOHШмвКЃЌМгШШЃЌВњЩњФмДйЪЙЪЊШѓКьЩЋЪЏШяЪджНБфРЖЕФЦјЬх1.12 L(вбЛЛЫуГЩБъзМзДПіЃЌМйЖЈВњЩњЕФЦјЬхШЋВПвнГі)ЁЃ
(1)ШмвКвЛЖЈДцдкЕФРызгга____ЃЌПЩФмДцдкЕФРызгга______ЃЛ
(2)дШмвКжаc(CO32ЁЊ)ЮЊ____ЃЌc(NH4+)____c(SO42ЁЊ) (ЬюЁАЃОЁЂЃМЛђ=ЁБ)ЃЛ
(3)ШчЙћЩЯЪі6жжРызгЖМДцдкЃЌдђc(Cl)__c(SO42ЁЊ) (ЬюЁАЃОЁЂЃМЛђ=ЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com