
【题目】根据要求回答下列问题。
(1)用大理石和稀盐酸反应制CO2,产生CO2的体积与反应时间的关系如图所示,其中产生CO2速率最快的为____________段(选填“OE”、“EF”或“FG”),其主要原因为____________________,若要使该反应的反应速率加快,下列措施不可行的是______(选填序号);

①将大理石换用碳酸钙粉末 ②加入K2SO4溶液
③升高温度 ④加入NaCl固体
(2)请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,回答下列问题:
①该电池选择的电解质溶液为______(填化学式);
②负极材料为___________(填化学式),正极的电极反应式为______________;
③若导线上转移电子0.025mol,则生成银的质量为____g。
【答案】 EF 该反应为放热反应 ②④ AgNO3 Cu Ag+ + e-=Ag 2.7g
【解析】(1)由图像可知,在EF段的CO2体积增大很快,所以产生CO2速率最快的为EF段,其主要原是因为该反应为放热反应。若要使该反应的反应速率加快,①将大理石换用碳酸钙粉末,增大了反应物的接触面积,可行; ②加入K2SO4溶液,一方面硫酸根可与钙离子结合生成微溶物硫酸钙覆盖在大理石表面阻止反应进行,另一方面溶液中的水对盐酸进行了稀释也减少了反应速率,所以不可行;③升高温度 可加快化学反应速率,可行; ④加入NaCl固体,不能加快化学反应速率,不可行。所以不可行的有②④。
(2)利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,根据原电池原理,该反应中还原剂是铜,所以可用铜作负极,那么正极选一种没有铜活泼的金属或非金属;氧化剂是银离子,所以可选用硝酸银溶液作为电解质溶液。
①该电池选择的电解质溶液为AgNO3;
②负极材料为Cu,正极的电极反应式为Ag+ + e-=Ag;
③若导线上转移电子0.025mol,则生成银的物质的量为0.025mol,质量为0.025mol![]() g/mol= 2.7g。
g/mol= 2.7g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学计量的叙述,正确的是( )
A.H2SO4的摩尔质量为98g
B.1molH2SO4的质量为98g/mol
C.标准状况下2molO2的体积约为44.8L
D.室温常压下气体摩尔体积约为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系正确的是
A. 锂比能量(单位质量的电极材料放出电能的大小)大,可用作电池负极
B. 浓硫酸具有脱水性,可用于干燥氯气
C. (NH4)2SO4浓溶液使蛋白质溶液发生盐析,可用于杀菌消毒
D. 铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
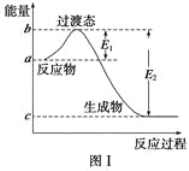
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2.0 L恒容密闭容器中充入1.0 mol PCl5,在温度为T℃时发生如下反应PCl5(g) ![]() PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
时间t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
回答下列问题:
(1)反应在前50 s的平均速率v(PCl5) = 。
(2)温度为T℃时,该反应的化学平衡常数= 。
(3)要提高上述反应的转化率,可采取的措施是 (任写一种)。
(4)在温度为T℃时,若起始时充入0.5 mol PCl5和a mol Cl2,平衡时PCl5的转化率仍为20%,则
a= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是 ( )
A. 向0.1mol/L的CH3COOH溶液中加少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)有X、Y、Z三种短周期元素,已知X的气态氢化物的分子式为H2X,该氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17∶40,X原子核内质子数与中子数相等;Y与X可形成离子化合物Y2X,Y的阳离子的电子层结构与Ne相同。Z与X处于同一周期,其气态单质是双原子分子,两原子共用一对电子。
(1)写出各元素的符号:X______,Y______,Z______。
(2)X的相对原子质量为____________,其离子的结构示意图为________。
(3)Y单质在空气中燃烧的化学方程式是________________________,该生成物与水反应的化学方程式是______________________。
(4)X与氢气化合的产物的电子式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com