
【题目】一种用烃A合成高分子化合物N的流程如下图: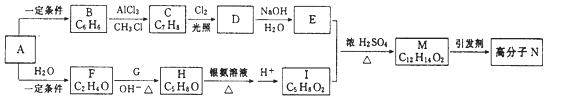
经测定烃A在标准状况下的密度为1.16g·L-1 , F和G是同系物,核磁共振氢谱显示有机物H中有四种峰,且峰值比为3:3:1:1。
已知:Ⅰ. 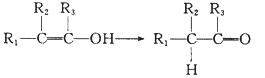
Ⅱ. ![]()
Ⅲ. 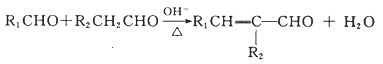 (R1、R2、R3代表烃基或氢原子)。
(R1、R2、R3代表烃基或氢原子)。
回答下列问题:
(1)写出A的结构简式:。
(2)H中所含官能团的名称是。
(3)H→I、M→N的反应类型分别是、。
(4)写出F和G反应生成H的化学方程式。
(5)E和I反应生成M的化学方程式为。
(6)芳香族化合物Q是M的同分异构体,与M具有相同官能团,且水解可以生成2-丙醇,则Q的种类有种。(不考虑立体异构)
【答案】
(1)CH≡CH
(2)醛基、碳碳双键
(3)氧化反应;加聚(或聚合)反应
(4)
(5)
(6)5
【解析】(1)A的结构简式为CH≡CH;
(2)H结构简式为CH3CH=C(CH3)CHO,,H中所含官能团的名称是醛基、碳碳双键 ;
(3)H→I、M→N的反应类型分别是氧化反应、加聚(或聚合)反应 ;
(4)F和G反应生成H的化学方程式 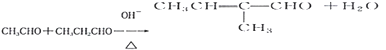 ;
;
(5)E和I反应生成M的化学方程式为  ;
;
(6)M的结构简式为 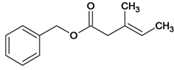 ,芳香族化合物Q是M的同分异构体,与M具有相同官能团,说明含有碳碳双键和酯基,且水解可以生成2-丙醇,如果水解后的羧酸中取代基为-COOH、-CH=CH2 , 有邻间对三种结构,取代基为-CH=CHCOOH有1种,取代基为-C(COOH)=CH2有1种,所以符合条件的Q有5种。
,芳香族化合物Q是M的同分异构体,与M具有相同官能团,说明含有碳碳双键和酯基,且水解可以生成2-丙醇,如果水解后的羧酸中取代基为-COOH、-CH=CH2 , 有邻间对三种结构,取代基为-CH=CHCOOH有1种,取代基为-C(COOH)=CH2有1种,所以符合条件的Q有5种。
所以答案是:(1)CH≡CH;(2)醛基、碳碳双键;(3)氧化反应;加聚(或聚合)反应;(4) ;(5)
;(5) ;(6)5
;(6)5


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是( )
A. 氧原子的杂化类型发生了改变 B. 微粒的形状发生了改变
C. 微粒的化学性质发生了改变 D. 微粒中的键角发生了改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要除去下列各组物质中的少量杂质,所选试剂和方法可行的是( )
选 项 | 物 质 | 杂 质 | 试剂、方法 |
A | CO2气体 | HCl气体 | 通过NaOH溶液,洗气 |
B | 铜粉 | 镁粉 | 硫酸,过滤 |
C | FeCl2溶液 | ZnCl2 | 加入适量铁粉,过滤 |
D | MnO2 | KMnO4 | 加 热 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
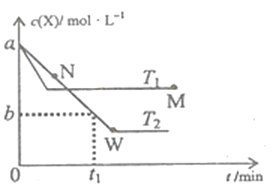
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸甲脂是—种重要的工业原料,某实验小组制取丙烯酸甲脂的装置如图所示: 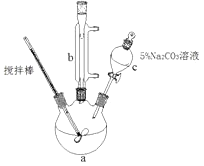
CH2=CHCOOH+HOCH3 ![]() CH2=CHCOOCH3+H2O
CH2=CHCOOCH3+H2O
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性。
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分。
可能用到的信息:
沸点 | 溶解性 | ||
丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
回答下列问题:
(1)仪器b的名称是。
(2)混合液用5%Na2CO3溶液洗涤的目的是。
(3)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出、。![]()
![]()
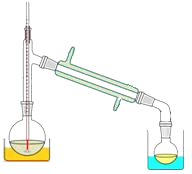
为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解。
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸18.00mL。
(4)计算本次酯化反应丙烯酸的转化率。
(5)请列举2条本实验中需要采取的安全防护措施、。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在饱和氯水中能大量共存的是( )
A.Fe2+、Na+、Cl﹣、NO3﹣
B.Na+、Al3+、SO42﹣、Cl﹣
C.NH4+、K+、NO3﹣、S2﹣
D.Na+、K+、HCO3﹣、SiO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜可用于消毒、制杀虫剂、镀铜等。实验小组制取CuSO4·5H2O晶体并进行热分解的探究。请回答以下问题:
探究Ⅰ:制取CuSO4·5H2O晶体
小组同学设计了如下两种方案:
甲:将铜片加入足量浓硫酸中并加热
乙:将铜片加入稀硫酸,控温40~50℃,滴加双氧水
(1)方案甲发生反应的化学方程式为____________,反应结束后有大量白色固体析出。简述从中提取CuSO4·5H2O晶体的方法:倒出剩余液体,____________。
(2)方案乙发生反应:Cu+H2SO4+H2O2=CuSO4+2H2O,该实验控温40~50℃的原因是________;与方案甲相比,方案乙的主要优点有_________、___________。(写出2种)
探究Ⅱ:用以下装置(加热装置省略)探究CuSO4·5H2O晶体热分解产物

已知:CuSO4·5H2O脱水后升高温度,会继续分解成CuO和气体产物,气体产物可能含有SO3、SO2、O2中的1~3种。
(3)称5.00gCuSO4·5H2O于A中加热,当观察到A中出现_____________,可初步判断晶体已完全脱水并发生分解。加热一段时间后,A中固体质量为3.00g,则此时A中固体的成分为___________。
(4)装置B中迅速生成白色沉淀,说明分解产物中有__________,C装置的作用是____________。
(5)理论上E中应收集到VmL气体,事实上体积偏少,可能的原因是______________。(不考虑泄漏等仅器与操作原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________________。
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。

①温度为T2时,0~2 min 内,CO2的平均反应速率 υ(CO2)=______________。
②b点时CO的转化率为_______,化学反应的平衡常数K=_____(填表达式)。
③反应:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左” “向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化 B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化 D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:
①Na2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol1
Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol1
②Cl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ΔH2=b kJ·mol1
HCl(aq)+HClO(aq) ΔH2=b kJ·mol1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH2=C(CH3)2和![]() 为原料可制备香料E(C11H12O2),其合成路线如下:
为原料可制备香料E(C11H12O2),其合成路线如下:
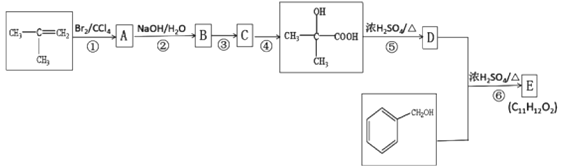
已知C 能发生银镜反应,D能使酸性高锰酸钾溶液褪色。请回答下列问题:
(1) 根据系统命名法有机物CH2=C(CH3)2的名称为___________;
(2) C 中能发生银镜反应的官能团名称是___________;
(3) ⑤的反应类型是_________;
(4) 写出⑥反应的化学方程式:__________________;
(5) 含苯环的![]() 的同分异构体有______种(不包含
的同分异构体有______种(不包含![]() ),其中核磁共振氢谱图有4 組峰且能与FeCl3溶液发生显色反应的有机物的结构简式为________;
),其中核磁共振氢谱图有4 組峰且能与FeCl3溶液发生显色反应的有机物的结构简式为________;
(6) 参照上述合成路线设计一条由乙烯制备聚乙二酸乙二酯的合成路线(无需注明反应条件)______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com