
下列实验操作与实验目的或结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成 | 该酸雨试样中一定含有H2SO4 |
B | 将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡 | 形成的原电池中锌作负极,银作正极 |
C | 某无色溶液,加银氨溶液,水浴加热,有银镜生成 | 溶液中一定含有醛类化合物 |
D | 配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe 2+水解,并防止Fe 2+被氧化为Fe3+ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届辽宁省高三上学期12月月考理综化学试卷(解析版) 题型:填空题
欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量。该反应的热化学方程式: 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
T/℃ n/mol | 活性炭 | NO | E | F |
初始 | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2。
Ⅰ.K1 = 。(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO 为阳极燃气,空气与 CO2 的混合气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO-4e—+ 2CO32— =4CO2 ,则阴极反应式为: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期末模拟化学试卷(解析版) 题型:填空题
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
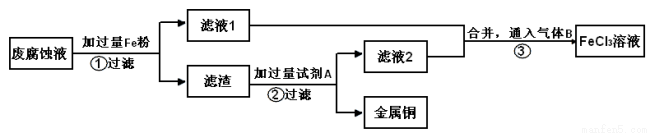 学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:选择题
下列事实中,与电化学腐蚀无关的是
A.在空气中,光亮的银表面逐渐变暗
B.为保护海轮的船壳,常在船壳上镶入锌块
C.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
D.镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:选择题
下列晶体分类中正确的是一组是
离子晶体 | 原子晶体 | 分子晶体 | |
A | NaOH | Ar | SO2 |
B | H2SO4 | 石墨 | S |
C | CH3COONa | 水晶 |
|
D | Ba(OH)2 | 金刚石 | 玻璃 |
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
下列说法正确的是
A.氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l) 2H2(g)+O2(g) △H=+285.5k•Jmol-1
2H2(g)+O2(g) △H=+285.5k•Jmol-1
B.反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) +3H2(g)═2NH3(g)△H=-38.6k•Jmol-1
D.由C(石墨,s)=C(金刚石,s) △H=+1.90 k•Jmol-1可知,金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三上学期统考理综化学试卷(解析版) 题型:填空题
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,H2SO4溶解Al2O3的离子方程式为:______________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:_______________________。
(3)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:__________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是________________________、________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列各组离子在无色酸性溶液中可以大量共存的有
A. Ag+、K+、NO3–、Cl– B.K+、Cu2+、SO42–、HCO3–
C.Mg2+、Cl–、SO42–、Na+ D.CO32–、K+、NO3–、Na+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法正确的是
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com