
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
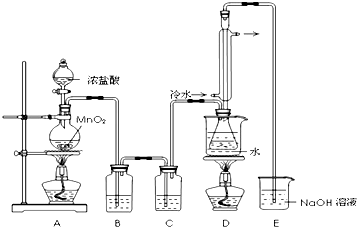
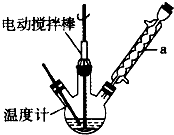
分析 A装置是利用浓盐酸和二氧化锰制取氯气,氯气中含有HCl,用B装置除去氯气中的HCl,应该用饱和食盐水;因为S2Cl2易与水反应,所以得到的氯气必须是干燥的,则C装置是干燥氯气,试剂是浓硫酸;在装置D中水浴加热制取S2Cl2,温度小于100℃;然后将尾气通入NaOH溶液中防止污染大气;
(1)在装置D中水浴加热制取S2Cl2,温度小于100℃,根据反应温度确定反应原理;
(2)氯气能和水反应生成酸,且氯气具有强氧化性,如果更换C装置来干燥氯气,应该用非还原性且为酸性或中性的物质;
(3)冷凝管有冷凝、回流、导气的作用;互溶的液体采用蒸馏方法分离提纯;
(4)S2Cl2与足量水反应有黄色沉淀生成,说明有S生成,产生的无色气体能使品红溶液褪色,说明有二氧化硫生成,根据元素守恒知,还生成HCl;
(5)为了提高制得的产品S2Cl2的纯度,应该控制温度和流速;
(6)S2Cl2遇水水解,E中氢氧化钠溶液中水蒸气易挥发进入D中;
(7)n( MnO2)=$\frac{26.1g}{87g/mol}$=0.3mol,根据转移电子相等生成n( Cl2)=$\frac{0.3mol×2}{2}$=0.3mol,根据CS2+3Cl2$\frac{\underline{\;95-100℃\;}}{\;}$CCl4+S2Cl2得n(S2Cl2)=$\frac{1}{3}$n( Cl2)=$\frac{1}{3}$×0.3mol=0.1mol,m(S2Cl2)=0.1mol×135g/mol=13.5g,本实验的产率=$\frac{10.8g}{13.5g}×100%$.
解答 解:A装置是利用浓盐酸和二氧化锰制取氯气,氯气中含有HCl,用B装置除去氯气中的HCl,应该用饱和食盐水;因为S2Cl2易与水反应,所以得到的氯气必须是干燥的,则C装置是干燥氯气,试剂是浓硫酸;在装置D中水浴加热制取S2Cl2,温度小于100℃;然后将尾气通入NaOH溶液中防止污染大气;
(1)在装置D中水浴加热制取S2Cl2,温度小于100℃,根据反应温度确定反应原理为①,故答案为:①;
(2)氯气能和水反应生成酸,且氯气具有强氧化性,如果更换C装置来干燥氯气,应该用非还原性且为酸性或中性的物质,则则装置C中可选用的固体试剂是无水CaCl2(或固体P2O5),故答案为:无水CaCl2(或固体P2O5);
(3)冷凝管有冷凝、回流、导气的作用;互溶的液体采用蒸馏方法分离提纯,生成的四氯化碳和S2Cl2互溶,应该用蒸馏方法分离提纯,故答案为:冷凝、回流、导气;蒸馏;
(4)S2Cl2与足量水反应有黄色沉淀生成,说明有S生成,产生的无色气体能使品红溶液褪色,说明有二氧化硫生成,根据元素守恒知,还生成HCl,反应方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,
故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑;
(5)微热的情况下S2Cl2能被过量Cl2氧化,为了提高产品S2Cl2的纯度,通入氯气的速率不能过快,所以实验操作的关键是控制好温度和控制浓盐酸的滴速不能太快,
故答案为:控制浓盐酸的滴速不能太快;
(6)D收集产品,E中氢氧化钠溶液中水蒸气易挥发,进入D中,易使S2Cl2水解,所以在D和E之间增加干燥装置,同时尾气吸收要防倒吸,
故答案为:在D和E之间增加干燥装置,同时尾气吸收要防倒吸;
(7)n( MnO2)=$\frac{26.1g}{87g/mol}$=0.3mol,根据转移电子相等生成n( Cl2)=$\frac{0.3mol×2}{2}$=0.3mol,根据CS2+3Cl2$\frac{\underline{\;95-100℃\;}}{\;}$CCl4+S2Cl2得n(S2Cl2)=$\frac{1}{3}$n( Cl2)=$\frac{1}{3}$×0.3mol=0.1mol,m(S2Cl2)=0.1mol×135g/mol=13.5g,
本实验的产率=$\frac{10.8g}{13.5g}×100%$=80%,
故答案为:80%.
点评 本题考查了氯气实验室制备方法、混合物分离提纯、杂质气体除杂的装置选择和试剂选择、题干信息的应用分析、化学方程式书写方法等,侧重考查学生分析判断及知识综合运用能力,明确实验原理及物质性质,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.8mol/(L•min) | |
| B. | 2min末时的反应速率,用B表示为0.6mol/(L•min) | |
| C. | 用C表示的反应速率是0.4mol/(L•min) | |
| D. | 若用D表示反应速率是0.8mol/(L•min),则x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电子式: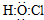 | |
| C. | 氮原子的结构示意图: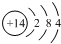 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲醛(
苯甲醛(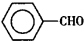 )、苯甲酸(
)、苯甲酸(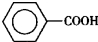 )都是重要的化工原料,都可用甲苯(
)都是重要的化工原料,都可用甲苯(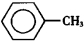 )为原料生产.下表列出了有关物质的部分物理性质,请回答:
)为原料生产.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 ρ水=1g/cm3 | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
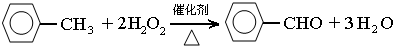 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
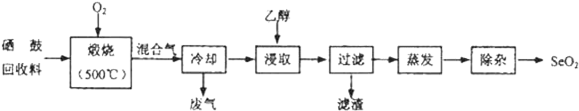
| 物质 | 熔点 | 沸点 | 溶解度 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
查看答案和解析>>
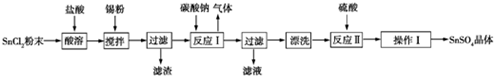
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+个数为0.02NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 含有NA个氧原子的氧气在标准状况下的体积为22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com