
����˵��������� ( )
A. ʳ��������������Һ�ζ���ʼʱ����Һ��PHͨ���仯���������ӽ���ȫ��Ӧʱ�����ζ��յ㣩��PH����ͻ�䣬��Ϊ�ζ�ͻԾ��
B. ֽ���������������Ӻ�ͭ����ʵ���У����������ֽ���ɺ���ĩ�˽���չ������Լ0.5cm��
C. Cu2+��������ˮ��Ӧ�����ӷ���ʽ Cu2++2NH3��H2O==Cu(OH)2��+2NH4+
D. ����ر�����Һ��ȴδ���ֽᾧʱ�������ò������ĥ������ڴ�ʹ����������
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Dz�ͬpH����ʱijŨ�ȸ��ᣨH2CrO4����Һ�У�����Ũ�ȣ�mol/L����pH�Ĺ�ϵ������˵��������ǣ�������
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | Y |
| Z | W |
| A��Z��ԭ������������X������ |
| B�����ʵĻ����Կ�����Y��Z |
| C��X��Z������������Ӧˮ������ܾ�Ϊǿ�� |
| D���ֱ���Y��W�γɵĵ��ʿ��ܶ���ԭ�Ӿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A����ӦN2��g��+3H2��g��
| |||||
| B����ѧƽ�ⳣ����������ʵĵ���ƽ�ⳣ�����ܶȻ�������ֻ���¶ȵ�Ӱ�� | |||||
| C������������ʵĵ���ƽ�ⳣ�������¶�һ��ʱ������ƽ�ⳣ��ԽС��������Խǿ | |||||
| D����AgNO3��Һ��KCl��Һ��Ϻ���c��Ag+��?c��Cl-����KSP��AgCl��������Һ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
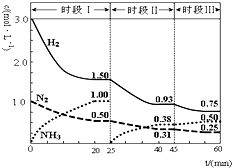 N2��g��+3H2��g���T2NH3��g����H=-92.4kJ?mol-1��1L�ܱպ��������У���Ӧ��ϵ�и�����Ũ����ʱ��仯��������ͼʾ������˵��������ǣ�������
N2��g��+3H2��g���T2NH3��g����H=-92.4kJ?mol-1��1L�ܱպ��������У���Ӧ��ϵ�и�����Ũ����ʱ��仯��������ͼʾ������˵��������ǣ�������| A��ǰ20���ӷ�Ӧ���ת����Ϊ50% | B����25���Ӹı�������ǽ�NH3�ӷ�Ӧ��ϵ�з����ȥ | C��ʱ�������ʼͶ�ŵ�����Ũ������ԭ����2������Ӧ���ת��������ƽ�ⳣ������ | D������60����ʱ��Ӧ�ִﵽ��ƽ�⣬��ʱ��ı�������ǽ����¶� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com