
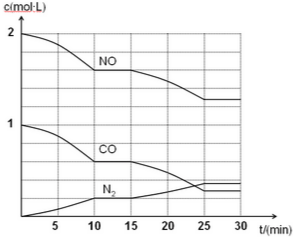
·ÖĪö £Ø1£©¢Łøł¾Ż¹«Ź½v=$\frac{”÷c}{”÷t}$Ą“½ųŠŠ¼ĘĖć¼“æÉ£»
¢Śøł¾ŻµŖĘųµÄ±ä»ÆĄ“Č·¶ØNO”¢COµÄ±ä»Æ£»½įŗĻĶ¼Ļóøł¾ŻĶā½ēĢõ¼ž¶Ō»ÆŃ§Ę½ŗāµÄÓ°ĻģĄ“ÅŠ¶Ļ£»
¢ŪŌŁĻņČŻĘ÷ÖŠ³äČėNO”¢N2ĘųĢåø÷1mol£¬·ÖÄøŌö¼ÓµÄ·ł¶Č“󣬵¼ÖĀQC¼õŠ”ÓÉ“ĖČ·¶ØĘ½ŗāŅĘ¶Æ·½Ļņ£»
£Ø2£©A£®Ōö¼ÓÅÅĘų¹Ü³¤¶Č£¬Ōö“óĮĖĻąµ±ÓŚŌö“óĮĖ¹ĢĢåµÄ½Ó“„Ć껿£¬¼ÓæģĮĖ»Æѧ·“Ó¦ĖŁĀŹ£¬¶ŌĘ½ŗāĪŽÓ°Ļģ£»
B£®Ōö“óĪ²ĘųÅÅ·ÅæŚ£¬¶Ō·“Ó¦ĖŁĀŹŗĶĘ½ŗā²»²śÉśÓ°Ļģ£»
C£®ÉżøßÅÅĘų¹ÜĪĀ¶Č£¬ĪĀ¶ČÉżøߣ¬Ę½ŗā×óŅĘ£¬²»ĄūÓŚNOx×Ŗ»Æ£»
D£®Ģķ¼ÓŗĻŹŹµÄ“߻ƼĮ£¬¼Óæģ»Æѧ·“Ó¦ĖŁĀŹ£¬¶ŌĘ½ŗāĪŽÓ°Ļģ£®
½ā“š ½ā£ŗ£Ø1£©¢Ł·“Ó¦½ųŠŠµ½10minŹ±£¬Ķ¼Ļó·ÖĪöæÉÖŖNOÅØ¶Č±ä»ÆĪŖ2mol/L-1.6mol/L=0.4mol/L£¬NOµÄĘ½¾ł·“Ó¦ĖŁĀŹ=$\frac{0.4mol/L}{10min}$=0.04mol/L•min£¬
¹Ź“š°øĪŖ£ŗ0.04mol/L•min£»
¢ŚÓÉĶ¼ĻóæÉÖŖ£¬15min”«25minÄŚNO”¢COÅضČŌŚ¼õÉŁ£¬N2µÄÅضČŌŚŌö¼Ó£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬½µµĶĪĀ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬
¹Ź“š°øĪŖ£ŗ½µµĶĪĀ¶Č£»
¢Ū»ÆŃ§Ę½ŗā³£ŹżµČÓŚĘ½ŗāŹ±Éś³ÉĪļµÄÅضČĆŻÖ®»ż±ČÉĻ·“Ó¦ĪļÅضČĆŻÖ®»ż£¬ĖłŅŌK=$\frac{{c}^{2}£ØC{O}_{2}£©c£Ø{N}_{2}£©}{{c}^{2}£ØNO£©{c}^{2}£ØCO£©}$£¬ÓÉĘ½ŗā³£Źż±ķ“ļŹ½æÉÖŖŅ»Ńõ»ÆµŖµÄĻµŹżŹĒ2“Ī·½£¬ĖłŅŌŌŁĻņČŻĘ÷ÖŠ³äČėNO”¢N2ĘųĢåø÷1mol£¬·ÖÄøŌö¼ÓµÄ·ł¶Č“󣬵¼ÖĀQC¼õŠ”£¬¼“Ę½ŗāÄęĻņŅĘ¶Æ£¬¼“Ļņ×óŅĘ¶Æ£¬
¹Ź“š°øĪŖ£ŗĻņ×ó£»
£Ø2£©xC£Øs£©+2NOx£Øg£©?N2£Øg£©+xCO2 £Øg£©”÷H=-b kJ•mol-1£®“Ė·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬
A£®Ōö¼ÓÅÅĘų¹Ü³¤¶Č£¬Ōö“óĮĖĻąµ±ÓŚŌö“óĮĖ¹ĢĢåµÄ½Ó“„Ć껿£¬¼ÓæģĮĖ»Æѧ·“Ó¦ĖŁĀŹ£¬¹ŹAÕżČ·£»
B£®Ōö“óĪ²ĘųÅÅ·ÅæŚ£¬¶Ō·“Ó¦ĖŁĀŹŗĶĘ½ŗā²»²śÉśÓ°Ļģ£¬¹ŹB“ķĪó£»
C£®ÉżøßÅÅĘų¹ÜĪĀ¶Č£¬ĪĀ¶ČÉżøߣ¬Ę½ŗā×óŅĘ£¬²»ĄūÓŚNOx×Ŗ»Æ£¬¹ŹC“ķĪó£»
D£®Ģķ¼ÓŗĻŹŹµÄ“߻ƼĮ£¬¼Óæģ»Æѧ·“Ó¦ĖŁĀŹ£¬¹ŹDÕżČ·£»
¹Ź“š°øĪŖ£ŗAD£®
µćĘĄ ±¾Ģāæ¼²é½ĻĪŖ×ŪŗĻ£¬Éę¼°·“Ó¦ČČµÄ¼ĘĖć”¢·“Ó¦×Ō·¢ŠŌµÄÅŠ¶Ļ”¢»Æѧ·“Ó¦ĖŁĀŹŗĶ»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲÓėĶ¼ĻóµÄ¹ŲĻµ”¢Ę½ŗā³£ŹżµÄ¼ĘĖćµČÖŖŹ¶£¬ĪŖøßĘµæ¼µć£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH4 | B£® | C2H6 | C£® | C6H6 | D£® | C6H6O2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
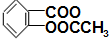 £©2]µÄĻūŃ××÷ÓƱȰ¢Ė¾Ę„ĮÖĒæŹ®¶ą±¶£¬ĖüĪŖĮĮĄ¶É«½į¾§·ŪÄ©£¬ÓöĒæĖį½āĄėĪŖ°¢Ė¾Ę„ĮÖ£Ø
£©2]µÄĻūŃ××÷ÓƱȰ¢Ė¾Ę„ĮÖĒæŹ®¶ą±¶£¬ĖüĪŖĮĮĄ¶É«½į¾§·ŪÄ©£¬ÓöĒæĖį½āĄėĪŖ°¢Ė¾Ę„ĮÖ£Ø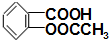 £¬M=180£©ŗĶCu2+£»
£¬M=180£©ŗĶCu2+£»| °¢Ė¾Ę„ĮÖČܽāÖŹĮæ | °¢Ė¾Ę„ĮÖĶµÄČܽāÖŹĮæ | |
| ĀČ·Ā | 0.4g | ²»ČÜ |
| ĪŽĖ®ŅŅ“¼ | 0.9g | ²»ČÜ |
| ÕōĮóĖ® | ²»ČÜ | ²»ČÜ |
| ŹµŃ鱹ŗÅ | °¢Ė¾Ę„ĮÖ£ŗĪŽĖ®ĮņĖįĶ/ĪļÖŹµÄĮæÖ®±Č | ²śĀŹ% | ||
| X1 | X2 | Ę½¾łÖµ | ||
| 1 | 1£ŗ1 | 76.6 | 78.1 | 77.4 |
| 2 | 2£ŗ1 | 78.6 | 75.1 | 76.8 |
| 3 | 3£ŗ1 | 93.9 | 95.9 | 94.9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 ŹµŃéŹŅÓūÓĆNaOH¹ĢĢåÅäÖĘ1.0mol•L-1µÄNaOHČÜŅŗ240mL£ŗ
ŹµŃéŹŅÓūÓĆNaOH¹ĢĢåÅäÖĘ1.0mol•L-1µÄNaOHČÜŅŗ240mL£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ū | B£® | ¢Ū¢Ü¢Ż | C£® | ¢Ł¢Ś¢Ü | D£® | ¢Ł¢Ū¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com