
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
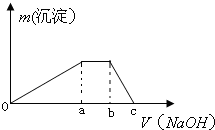 甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验:
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
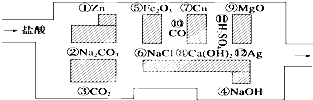
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | |
| 盐酸 | NaOH | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 铁触煤 |
| △ |
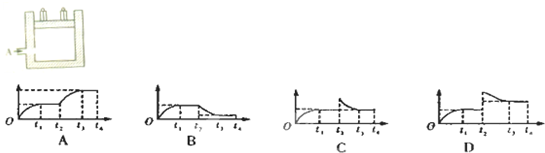
查看答案和解析>>
科目:高中化学 来源: 题型:
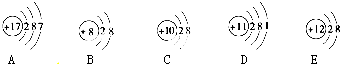
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | ||
| B、等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-=Mg(OH)2↓ | ||
| C、将过量的SO2通入Ca(ClO)2溶液中:SO2+ClO-+H2O=HClO+HSO3- | ||
D、将0.2 mol?L-1的NH4Al(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合:2Al3++3SO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com