
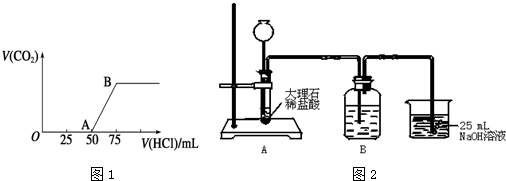
分析 (I)(1)碳酸钠和稀盐酸反应方程式为:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,根据图知,加入稀盐酸时没有气体生成,如果溶质完全是碳酸钠,碳酸钠和稀盐酸反应生成碳酸氢钠、碳酸氢钠和稀盐酸反应生成二氧化碳时消耗的稀盐酸体积应该相等,实际上OA段消耗盐酸量是AB段的2倍,说明溶液中溶质有Na2CO3和NaOH,OA段为NaOH、碳酸钠和稀盐酸的反应;
(2)中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(3)生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑计算二氧化碳体积;
(4)生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl),进而计算c(NaOH);
(II)①用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解,二者完全反应生成NaHCO3,发生NaOH+CO2=NaHCO3;
②小火煮沸溶液1min~2min,可除去溶液中过量的CO2;
③在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合,发生NaHCO3+NaOH=Na2CO3+H2O,得较纯净的Na2CO3,
(1)①、③两步的反应分别是NaOH和足量二氧化碳的反应、NaOH和碳酸氢钠的反应;
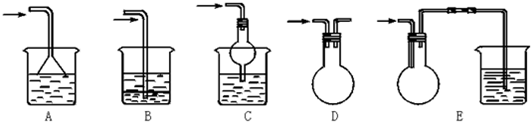
(2)A装置是制取二氧化碳,盐酸具有挥发性,所以生成的二氧化碳中含有HCl,B装置是除去二氧化碳中HCl,且不能引进新的杂质,应该用饱和碳酸氢钠溶液;
(3)如果实验步骤②③的顺序对调,溶液中溶解了部分二氧化碳,二氧化碳和氢氧化钠反应,使氢氧化钠的量减少,混合液中碳酸氢钠和氢氧化钠的物质的量不相等;
(4)有缓冲装置的能防止倒吸.
解答 解:(I)(1)碳酸钠和稀盐酸反应方程式为:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,根据图知,加入稀盐酸时没有气体生成,如果溶质完全是碳酸钠,碳酸钠和稀盐酸反应生成碳酸氢钠、碳酸氢钠和稀盐酸反应生成二氧化碳时消耗的稀盐酸体积应该相等,实际上OA段消耗盐酸量是AB段的2倍,说明溶液中溶质有Na2CO3和NaOH,OA段为NaOH、碳酸钠和稀盐酸的反应,离子方程式为:H++OH-═H2O、CO32-+H+═HCO3-,
故答案为:H++OH-═H2O、CO32-+H+═HCO3-;
(2)中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1,则二者的物质的量浓度之比为1:1,
故答案为:1:1;
(3)生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.025L×0.1mol/L×22.4L/mol=0.056L,
故答案为:0.056L;
D.生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度=$\frac{0.0075mol}{0.01L}$=0.75mol/L,
故答案为:0.75mol/L;
(II)①用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解,二者完全反应生成NaHCO3,发生NaOH+CO2=NaHCO3;
②小火煮沸溶液1min~2min,可除去溶液中过量的CO2;
③在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合,发生NaHCO3+NaOH=Na2CO3+H2O,得较纯净的Na2CO3,
(1)①、③两步的反应分别是NaOH和足量二氧化碳的反应、NaOH和碳酸氢钠的反应,反应方程式分别为NaOH+CO2=NaHCO3、NaHCO3+NaOH=Na2CO3+H2O,
故答案为:NaOH+CO2=NaHCO3;NaHCO3+NaOH=Na2CO3+H2O;
(2)A装置是制取二氧化碳,盐酸具有挥发性,所以生成的二氧化碳中含有HCl,B装置是除去二氧化碳中HCl,且不能引进新的杂质,应该用饱和饱和NaHCO3溶液,所以B中溶液是饱和NaHCO3溶液,作用是除去二氧化碳中HCl,
故答案为:饱和NaHCO3溶液;除去二氧化碳中HCl;
(3)如果实验步骤②③的顺序对调,溶液中溶解了部分二氧化碳,二氧化碳和氢氧化钠反应,使氢氧化钠的量减少,混合液中碳酸氢钠和氢氧化钠的物质的量不相等,所以NaOH溶液不能完全转化为Na2CO3.这样制取的Na2CO3中就会混有NaHCO3.
故答案为:不对;若不先除去溶液中溶解的CO2气体,则实验③加入的NaOH溶液将有一部分与CO2气体反应,使NaOH溶液不能完全转化为Na2CO3.这样制取的Na2CO3中就会混有NaHCO3;
(4)A.吸收装置中的导管下连漏斗,漏斗的边缘紧靠液面,有缓冲作用气体充分被吸收能防止倒吸,故A正确;
B.吸收装置中的导气管插入到液面,易吸收易溶性气体,但产生倒吸,故B错误;
C.与A相似,可起到防止倒吸作用,故C正确;
D.尾气没有被吸收,而是排放到大气中造成污染,故D错误;
E.吸收装置中的导管没直接伸入到液体中,而是与烧瓶连接紧密,有缓冲作用气体充分被吸收,能防止倒吸,故E正确.
故选ACE.
点评 本题考查物质制备、化学实验方案评价等知识点,为高频考点,侧重考查学生实验操作、实验分析、实验评价及计算能力,注意防倒吸的装置,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1﹕2﹕3 | B. | 1﹕1﹕1 | C. | 2﹕3﹕6 | D. | 3﹕2﹕1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2倍 | B. | 1.5倍 | C. | 0.9倍 | D. | 0.5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、CO32- | B. | Ag+、K+、Cl-、NO3- | ||
| C. | Cu2+、SO42-、Na+、CO32- | D. | Ba2+、OH-、Mg2+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com