
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | B | C | D | |||||
3 | E | F | G | H | I | J |
(1)表中元素,化学性质最不活泼的是__________,只有负价而无正价的是__________, 可用于制半导体材料的元素是_______。
(2)A分别与B、C、G、H形成的简单化合物中,最稳定的是__________,其中A和C形成的化合物溶于水,再向其中滴加酚酞溶液,会观察到________________。
(3)E、F、I元素形成的简单离子中,半径最大的是__________。
(4)写出F的单质与氢氧化钠溶液反应的化学方程式_________________。
【答案】 Ar F Si NH3 溶液变红 Cl- 2Al+2H2O+2NaOH=2NaAlO2+3H2↑
【解析】根据元素在周期表中的位置可知,A为H元素,B为C元素,C为N元素,D为F元素,E为Na元素,F为Al元素,G为Si元素,H为P元素,I为Cl元素,J为Ar元素。
(1)化学性质最不活泼的为稀有气体元素,是Ar,由于F的非金属性最强,只有负价而无正价, 常用于制半导体材料的元素是Si,故答案为:Ar;F ;Si;
(2)元素的非金属性越强,氢化物的稳定性越强, C、N、Si、P中非金属性最强的是N元素,因此最稳定的是NH3,氨水显碱性,在氨水中滴加酚酞溶液,溶液变红,故答案为:NH3;溶液变红;
(3)一般而言,电子层数越多,离子半径越大,E、F、I元素形成的简单离子中,半径最大的是氯离子,故答案为:Cl-;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑,故答案为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑;


科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。

⑴取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。

②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原_____________________________。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ:______________________________;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:_____________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中_____________,实验b中_________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学生利用下图装置测定反应过程中所放出的热量并计算中和热。所用药品为50ml 0.50mol·L-1盐酸与50ml 0.55mol·L-1NaOH溶液。请回答下列问题:
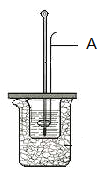
(1)图中A仪器名称为__________。其作用为__________。
(2)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是____________。
A.测量盐酸的温度后,温度计没有用水冲洗干净,立即去测量氢氧化钠溶液的温度
B.把量筒中的氢氧化钠溶液一次性快速倒入小烧杯
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
II.(1)原电池是将化学能转化为电能的装置,现将下列化学反应设计成带盐桥原电池,请你画出该原电池装置简图(标明电极材料名称和试剂名称):Zn+CuSO4= ZnSO4+Cu_________
(2)盐桥中的阴离子向_________(填正极或负极)迁移。
III.下图为甲醇(CH3OH)燃料电池装置,该装置能量转化率可达90%,当通入67.2L(标况下)氧气时,产生1306kJ电能,则甲醇液体的燃烧热的热化学方程式为____________。
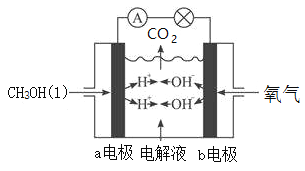
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,可逆反应A(s)+2B(g) ![]() C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
A.v (B)正=2 v (C)逆 B.容器内每消耗1 molD,同时生成1molD
C.容器内气体的密度不变 D.向容器中加入少量A,平衡正向移动,K不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室合成了一种可溶的金属氯化物(RClx),为了测定该金属氯化物的成分,研究人员做了以下实验:取物质的量浓度为0.05 mol·L-1的金属氯化物(RClx) 溶液20 mL,使之恰好与20 mL 0.15 mol·L-1的AgNO3溶液完全反应。则该氯化物的化学式为
A. RCl B. RCl2 C. RCl3 D. RCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。下列说法正确的是

A. Y、Z、W处于同一周期
B. X、Y、Z、W的原子序数递增
C. X、W可形成化学式为XW的离子化合物
D. 简单离子半径是Z小于W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com