
| A. | CH3CH2CH2OH | B. | (CH3)3CCH2OH | C. | HOCH2CHBrCH3 | D. | CH3OH |
分析 连接醇羟基或卤原子的C原子相邻碳原子上含有H原子的醇或卤代烃能发生消去反应,连接醇羟基的碳原子上含有2个H原子的醇能被氧化生成醛,据此分析解答.
解答 解:连接醇羟基或卤原子的C原子相邻碳原子上含有H原子的醇或卤代烃能发生消去反应,连接醇羟基的碳原子上含有2个H原子的醇能被氧化生成醛,
A.1-丙醇中连接醇羟基碳原子相邻碳原子上含有H原子,所以能发生消去反应生成丙烯,连接醇羟基碳原子上含有2个H原子,所以能发生催化氧化反应生成醛,故A正确;
B.连接醇羟基碳原子相邻碳原子上不含氢原子,所以不能发生消去反应,故B错误;
C.该物质发生催化氧化生成-CHO,但含有-Br,所以发生催化氧化反应得到的不是醛,故C错误;
D.该物质中只含一个碳原子,所以不能发生消去反应,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,侧重考查醇和卤代烃性质,明确醇或卤代烃发生消去反应结构特点是解本题关键,易错选项是C.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
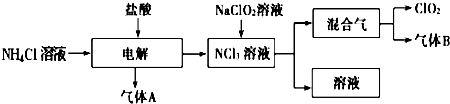
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x>y | B. | x<y | C. | x=y | D. | x≤y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
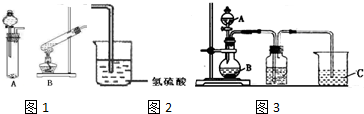

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有13个质子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
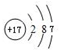 .
.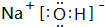 ,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程
,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程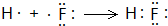 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com