
 教材中给出了Na2O2与H2O反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑.为了探究Na2O2与H2O反应的机理,某学习探究小组在教师指导下设计了如图装置进行实验.
教材中给出了Na2O2与H2O反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑.为了探究Na2O2与H2O反应的机理,某学习探究小组在教师指导下设计了如图装置进行实验.分析 开始时试管中无气体生成,滴入酚酞后,溶液变红色,说明Na2O2与H2O反应生成了碱和H2O2,然后滴入的稀盐酸中和NaOH,H2O2在C中分解生成O2,
(1)H2O2有强氧化性,能将I-氧化成碘单质,所以淀粉碘化钾试纸变蓝,据此写出反应的离子方程式;
(2)H2O2使KMnO4溶液褪色,体现了双氧水的还原性,说明双氧水被酸性高锰酸钾溶液氧化成氧气;
(3)双氧水不稳定,温度过高容易分解,则A中用冰盐冷浴可防止温度过高H2O2分解,C中用热水浴可使加快H2O2分解;
(4)根据实验可知,过氧化钠与水反应的机理为:Na2O2与H2O反应生成H2O2,H2O2遇热分解生成氧气,据此写出反应方程式.
解答 解:开始时试管中无气体生成,滴入酚酞,溶液变红色,说明Na2O2与H2O反应生成了碱和H2O2,然后滴入的稀盐酸中和NaOH,H2O2在C中分解生成O2,
(1)淀粉碘化钾试纸变蓝,说明H2O2有强氧化性,能将I-氧化成碘单质,反应的离子方程式为:2I-+2H++H2O2=I2+2H2O,
故答案为:2I-+2H++H2O2=I2+2H2O;
(2)酸性高锰酸钾溶液具有强氧化性,H2O2使KMnO4溶液褪色,体现了双氧水的还原性,反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
(3)双氧水不稳定,温度过高容易分解,则A中用冰盐冷浴,目的是防止温度过高H2O2分解;C中用热水浴可使H2O2分解,
故答案为:防止生成的H2O2分解,使H2O2分解;
(4)根据实验可知,过氧化钠与水反应的机理为:Na2O2与H2O反应生成H2O2,H2O2遇热分解生成氧气,反应方程式为:Na2O2+2H2O=2NaOH+H2O2、2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,
故答案为:Na2O2+2H2O=2NaOH+H2O2、2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
点评 本题考查了探究过氧化钠与水的反应原理,题目难度中等,明确实验目的及双氧水的性质为解答关键,注意掌握过氧化钠与水反应的机理,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
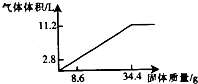 在100mlNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系,试回答:
在100mlNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | c (H+)=0.lmol•L-1的溶液中:Cu2+、A13+、SO42-、NO3- | |
| C. | 能使红色石蕊试纸变蓝的溶液中:K+、CO32-、NO3-、AlO2- | |
| D. | 在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠固体与水反应:2O22?+2H2O═4OH?+O2↑ | |
| B. | 氨水中通入过量二氧化硫:2NH3•H2O+SO2═2NH4++SO32?+H2O | |
| C. | 澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH?+HCO3?═CaCO3↓+H2O | |
| D. | 将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:2Al3++7OH?═Al(OH)3↓+AlO2?+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 4Fe2++2Br-+3Cl2═Br2+4Fe3++6Cl- | |
| D. | 2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟化氢的电子式:H+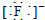 | B. | 氯原子的结构示意图: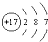 | ||
| C. | 乙酸的分子式:CH3COOH | D. | 1,2-二溴乙烷的结构简式:C2H4Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
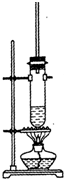 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )| A. | 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 不能用水浴加热 | |
| D. | 加入过量乙酸可以提高1一丁醇的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com