
在下列溶液中,各组离子一定能够大量共存的是
| A.pH=2的溶液:Fe3+、Cu2+、SO42-、NO3- |
| B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2- |
| C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO- |
| D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl- |
A
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中溶液显酸性,可以大量共存;B中溶液显碱性,则NH4+不能大量共存;C中水的电离平衡被破坏,溶液可能显酸性,也可能显碱性。如果显酸性,则ClO-不能大量共存。如果显碱性,则Al3+不能大量共存;选项D中溶液可能显酸性,也可能显碱性。如果显碱性,则Mg2+不能大量共存,答案选A。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:单选题
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 KNO3溶液:Mg2+、Fe2+、Cl-、SO42- |
| B.无色透明的溶液:Cu2+、NH4+、NO3-、CO32- |
| C.使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO- |
| D.水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式正确的是
| A.向CuSO4溶液中投入Na:Cu2++2Na=Cu+2Na+ |
| B.向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓ |
| C.向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D.向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+=Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子在溶液中能大量共存的一组是
| A.Fe3+、H+、ClO-、SO32- | B.K+、Al3+、Cl-、CO32- |
| C.Na+、Ca2+、HCO3-、OH- | D.Al3+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知250C时某溶液中含有大量Na+、H+、Fe3+、HC03-、OH-、I-中的几种,并且水电离出的c(H+) = 1×10-13mol/L。当向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色。下列有关分析正确的是
A.溶液的PH=1或13
B.溶液中一定没有Fe3+,Na+
c.溶液中阴离子有I-,不能确定HCO3-
D.当Cl2过量,所得溶液只含有两种盐
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式中,正确的
| A.在AlCl3溶液中加入过量氨水:Al3+ + 3NH3·H2O =Al(OH)3↓ + 3NH4+ |
| B.大理石加入过量盐酸中:CO32-+2H+= CO2↑+H2O |
| C.稀硫酸和Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D.在CuSO4溶液中加入Ba(OH)2溶液:Ba2+ + SO42- =BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应的离子方程式正确的是
| A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3- |
| C.用氯化铁溶液腐蚀电路板:Fe3++Cu=Fe2++Cu2+ |
| D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应 。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下: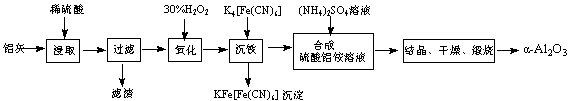
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 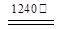 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com