
| 序号 | 各种化学变化 | 制备新物质或能量转化(主要) |
| 示例 | 实验室点燃酒精灯 | 化学能转变为热能 |
| 示例 | 利用氢气和氯气合成盐酸 | 制备新物质 |
| (1) | 从铜矿中提炼铜 | |
| (2) | 冬天,居民烧木炭取暖 | |
| (3) | 镁燃烧制照明弹 | |
| (4) | Pb+PbO2+2H2SO4$\frac{\underline{\;放电\;}}{\;}$2PbSO4+2H2O | |
| (5) | 6nH2O+6nCO2 $→_{叶绿素}^{光}$(C6H12O6)n+6nO2 |
分析 (1)提炼铜是制备新物质;
(2)取暖是转化为热能;
(3)制照明弹是转化为光能;
(4)反应产生电能;
(5)物质中存在化学能.
解答 解:(1)从铜矿中提炼铜制备新物质铜;(2)冬天,居民烧木炭取暖是化学能转变为热能;
(3)镁燃烧制照明弹是化学能转变为光能;
(4)Pb+PbO2+2H2SO4$\frac{\underline{\;放电\;}}{\;}$2PbSO4+2H2O是化学能转变为电能;
(5)6nH2O+6nCO2 $→_{叶绿素}^{光}$(C6H12O6)n+6nO2是光能转变为化学能;
故答案为:
| 序号 | 各种化学变化 | 制备新物质或能量转化(主要) |
| 示例 | 实验室点燃酒精灯 | 化学能转变为热能 |
| 示例 | 利用氢气和氯气合成盐酸 | 制备新物质 |
| (1) | 从铜矿中提炼铜 | 制备新物质 |
| (2) | 冬天,居民烧木炭取暖 | 化学能转变为热能 |
| (3) | 镁燃烧制照明弹 | 化学能转变为光能 |
| (4) | Pb+PbO2+2H2SO4$\frac{\underline{\;放电\;}}{\;}$2PbSO4+2H2O | 化学能转变为电能 |
| (5) | 6nH2O+6nCO2 $→_{叶绿素}^{光}$(C6H12O6)n+6nO2 | 光能转变为化学能 |
点评 本题考查常见的能量转化形式,难度不大,了解常见化学反应中伴随的能量变化与转化是正确解答本题的关键.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷在空气中燃烧 | B. | 金属钠与水反应 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 焦炭在高温下与水蒸气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
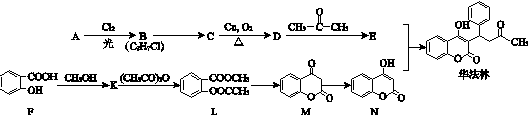
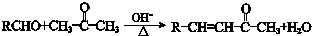
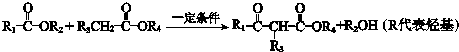
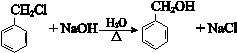 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
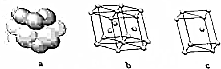 A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:| A | A是原子半径最小的元素 |
| B | B基态原子的价层电子排布式为nsnnpn |
| D | D原子最外层电子数是次外层电子数的三倍 |
| E | C的三价阴离子和E的二价阳离子具有相同的电子层结构 |
| F | F元素的基态原子有六个成单电子 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
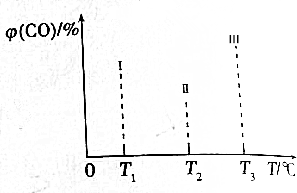
 如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:
如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
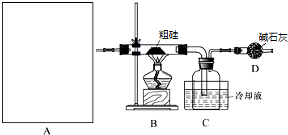
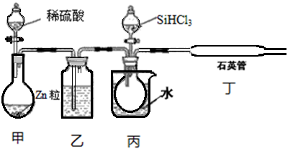
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com