
| A. | NH4+ K+ Na+ CO32- NO3- | B. | K+ Na+ Fe2+ SO42- NO3- | ||
| C. | NH4+ K+ Na+ HCO3-Cl- | D. | NH4+ K+ Na+ NO3- I- |
分析 pH=1的溶液中含有大量的H+,离子之间发生氧化还原反应而不能共存,并注意离子的颜色来解答.
解答 解:A.因H+、CO32-结合生成水和气体而不能共存,因发生复分解反应而不能共存,故A不选;
B.因H+、Fe2+、NO3-发生氧化还原反应而不能共存,但Fe2+为浅绿色,与无色溶液不符,故B不选;
C.因H+、HCO3-结合生成水和气体,H+、AlO2-结合沉淀,因复分解反应而不能共存,故C不选;
D.因H+、I-、NO3-发生氧化还原反应而不能共存,且离子均为无色,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应的离子共存考查,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
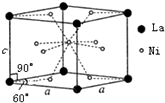 Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.
Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
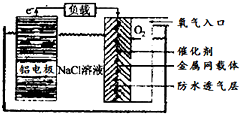 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.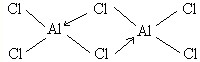 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组合分类 | 碱 | 酸 | 纯净物 | 碱性氧化物 | 酸性氧化物 |
| A | 烧碱 | H2SO4 | 盐酸 | CaO | SO3 |
| B | 纯碱 | HCl | 冰醋酸 | Na2O2 | CO2 |
| C | NaOH | CH3COOH | 冰水混合物 | Na2O | SO2 |
| D | KOH | HNO3 | 胆矾 | Al2O3 | CO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
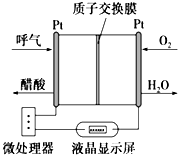 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.其中电极均为Pt电极.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.其中电极均为Pt电极.下列说法不正确的是( )| A. | 电流由O2所在的铂电极经外电路流向另一电极 | |
| B. | O2在右侧电极发生还原反应,且该电极附近溶液的pH升高 | |
| C. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
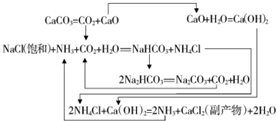
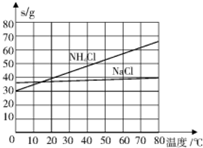 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.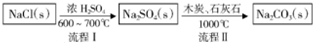
| 物质 | NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| s/g | 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 | |
| C. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1 mol Na2CO3晶体中含离子总数大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
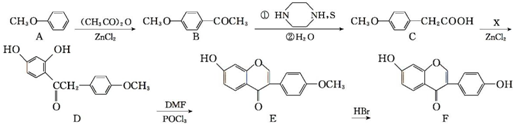
 ,写出该反应的化学方程式
,写出该反应的化学方程式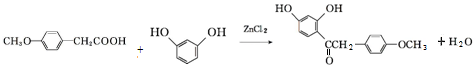 .
.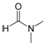 )在POCl3(三氯氧磷)的催化下反应生成E,同时还生成H2O和另一种有机物,写出该有机物的分子式C2H7N.
)在POCl3(三氯氧磷)的催化下反应生成E,同时还生成H2O和另一种有机物,写出该有机物的分子式C2H7N.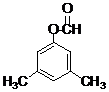 或
或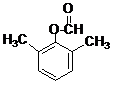 .(写出其中一种的结构简式)
.(写出其中一种的结构简式)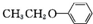 和(CH3CO)2O为原料制备
和(CH3CO)2O为原料制备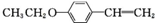 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 解释、结论 |
| A | 用玻璃棒蘸取浓氨水点到干燥红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | 向蔗糖中加入浓硫酸并搅拌 | 蔗糖变黑,体积膨胀 | 反应中浓硫酸只体现脱水性 |
| D | 过量的Fe粉与氯气充分反应后,向反应后的混合物中加水,取上层清液滴入KSCN溶液 | 溶液不变红色 | 氯气将Fe氧化为Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com