
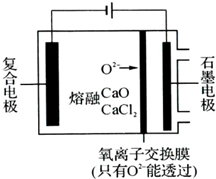
 纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:分析 Ⅰ(1)由流程图可知,TiCl4发生水解得到TiO2•nH2O,还生成HCl;
(2)TiO2•nH2O表面会附着氯离子,用硝酸酸化的硝酸银溶液检验最后一次洗涤液是否含有氯离子;
Ⅱ(3)复合电极为阴极,阴极上钙离子获得电子生成Ca,Ca立即还原TiO2得到Ti与CaO,TiO2能直接得电子生成Ti,同时得到O2-;
存在氧离子交换膜,没有CaO,不能提供氧离子,不能形成闭合回路;
(4)负极发生氧化反应,B2H6在负极失去电子生成BO2-和H2O,电解质溶液为碱性,有氢氧根离子参加反应.
解答 解:Ⅰ.(1)由流程图可知,TiCl4发生水解得到TiO2•nH2O,还生成HCl,其反应方程式为:TiCl4+(n+2)H2O=TiO2•nH2O+4HCl;
故答案为:TiCl4+(n+2)H2O=TiO2•nH2O+4HCl;
(2)检验洗涤是否洗涤干净,实质是检验TiO2•nH2O表面是否附着氯离子,具体方案为:取适量最后一次洗涤液,滴加硝酸酸化的硝酸银溶液,不产生白色沉淀,说明已经洗净,
故答案为:取适量最后一次洗涤液,滴加硝酸酸化的硝酸银溶液,不产生白色沉淀,说明已经洗净;
Ⅱ.(3)复合电极为阴极,阴极上钙离子获得电子生成Ca,Ca立即还原TiO2得到Ti与CaO,TiO2能直接得电子生成Ti,同时得到O2-,阴极区还发生的电极反应式为:Ca2++2e-=Ca,TiO2+4e-=Ti+2O2-;
装置中存在氧离子交换膜,如果没有CaO,不能提供氧离子,不能形成闭合回路,故不能去掉CaO,
故答案为:Ca2++2e-=Ca;TiO2+4e-=Ti+2O2-;不能;
(4)负极发生氧化反应,B2H6在负极失去电子生成BO2-和H2O,电解质溶液为碱性,有氢氧根离子参加反应,负极的电极反应式为:B2H6+14OH--12e-=2BO2-+10H2O,
故答案为:B2H6+14OH--12e-=2BO2-+10H2O.
点评 本题考查物质制备方案,涉及离子检验、原电池与电解原理、对原理的分析评价等,是对学生综合能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,组成一个原电池.
如图所示,组成一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L盐酸15mL | B. | 0.2mol/L盐酸12mL | ||
| C. | 0.15mol/L硫酸8mL | D. | 18mol/L硫酸15mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是Ag2O>H2O2>K2CrO4 | |
| B. | H2O2既体现氧化性又体现还原性的反应是①③ | |
| C. | H2O2仅体现氧化性的反应是② | |
| D. | H2O2仅体现还原性的反应是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.
羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com