
【题目】已知Cu、Ag都能溶解在硝酸中,某同学设计如下实验测量m g铜银合金样品中铜的质量分数,下列说法中正确的是( )
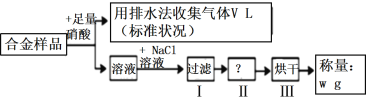
A. 被Cu还原的硝酸为![]() molB. 操作I所用到的玻璃仪器是烧杯、蒸发皿、玻璃棒
molB. 操作I所用到的玻璃仪器是烧杯、蒸发皿、玻璃棒
C. 操作Ⅱ为蒸发D. 铜的质量分数为![]() ×100%
×100%
【答案】D
【解析】
根据流程可知:铜银合金与足量硝酸反应生成硝酸铜、硝酸银溶液、NO或NO2气体,用排水法收集到的VL气体为NO;向反应后的溶液中加入氯化钠溶液,反应生成氯化银沉淀,过滤后得到氯化银固体,然后洗涤、干燥,最后得到干燥的AgCl固体,由此分析解答。
A. n(NO)=![]() mol,部分硝酸被还原,既有被Cu还原的,也有被Ag还原的硝酸,所以不能认为被还原的硝酸完全是被Cu还原产生,A错误;
mol,部分硝酸被还原,既有被Cu还原的,也有被Ag还原的硝酸,所以不能认为被还原的硝酸完全是被Cu还原产生,A错误;
B.操作I是过滤,所用到的玻璃仪器是烧杯、漏斗、玻璃棒,B错误;
C.操作Ⅱ为洗涤AgCl沉淀,C错误;
D.最后称量的固体质量是AgCl沉淀的质量,根据Ag元素守恒,可得n(Ag)=n(AgCl)=![]() mol,m(Ag)= n(Ag)·M=
mol,m(Ag)= n(Ag)·M=![]() g,则原混合物中Cu的质量分数为
g,则原混合物中Cu的质量分数为![]() ×100%=
×100%=![]() ×100%=
×100%=![]() ×100%,D正确;
×100%,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
(定性实验)检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_________和__________;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是________________;
(定量试验)测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.
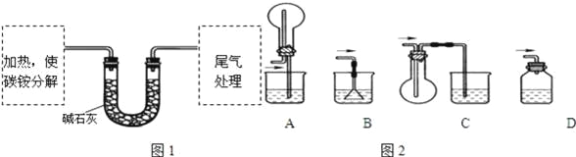
(3)碳铵固体应放在________中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2中的___________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,64g SO2中含有的原子数为3NA
B. 标准状况下,11.2L CCl4所含原子数目为2.5NA
C. 2L 0.1 molL﹣1K2SO4溶液中含K+物质的量为0.2 mol
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,下列说法正确的是( )

A. 甲气体肯定有NO2
B. 经过浓硫酸处理后余气中NO、CO2体积比为2:3
C. 甲气体的组成可能为NH3、NO、NO2
D. 经过Na2O2处理后剩余气体体积大于80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的乙烯和甲烷的下列说法中,不正确的是( )
A.碳原子个数比为 2∶1
B.氢原子个数比为1∶1
C.完全燃烧时,消耗氧气的体积比为2∶3
D.完全燃烧时,生成水的质量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。

(1)若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为____,当有1.6g负极材料溶解时,转移的电子为____mol;
(2)若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为______→ __________(填电极材料,下同),溶液中的NO3-向________极移动;
(3)氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为________________。
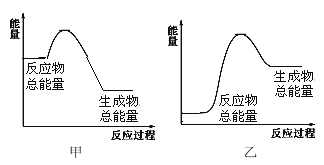
Ⅱ.已知H-H 键、N-H 键、N≡N 键的键能分别为 436kJ/mol、391kJ/mol、946 kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
(4)若有 1 mol NH3生成 ,可________(填“吸收”或“放出”)热量________kJ;该反应的能量变化可用图__________表示。(填“甲“或“乙”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,HCOOH(甲酸)比NH3H2O电离常数大。向10 mL 0.1mol/L HCOOH中滴加同浓度的氨水,有关叙述正确的是( )
A. 滴加过程中水的电离程度始终增大
B. 当加入10 mL NH3H2O时,c(NH4+) > c(HCOO-)
C. 当两者恰好中和时,溶液pH = 7
D. 滴加过程中n(HCOOH)与n(HCOO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O②气体液化的温度:NO2 21℃、 NO –152℃

(1)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是__________。
(2)该实验装置明显缺陷是 ________________________________________________。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是____________________________。
②装置B的作用是_______________________________________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)①水合肼(N2H4·H2O)是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素[CO(NH2)2]反应制得粗肼(N2H4)。生成粗肼反应的化学方程式为_______________。
②火箭发射时可用肼(N2H4)为燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反应方程式 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mLFeCl3溶液中使铜全部溶解(电路板上其他物质均不发生反应),测得电路板质量减少了3.2 g,在浸泡液中加足量的Fe粉并使之充分反应,过滤干燥固体,固体质量比加入的Fe粉质量减少了2.4g。
请计算:
(1)浸泡液中的溶质是__________(写化学式) 。
(2)参与反应的铁的质量是__________g。
(3)假设溶液的体积不变,最后所得溶液中c(Fe2+)=__________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com