
| A. | 定容时俯视刻度线,会使所配溶液浓度偏大 | |
| B. | 将4.0gNaOH固体溶于1L水中可配成0.1mol/L的NaOH溶液 | |
| C. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水到刻度线 | |
| D. | 称量时,将固体NaOH放在垫有纸的托盘天平左盘上 |
分析 A.定容时俯视刻度线,会导致溶液体积偏小;
B.n(NaOH)=$\frac{4.0g}{40g/mol}$=0.1mol,将4.0gNaOH固体溶于1L水中,溶液的体积大于1L;
C.NaOH溶解过程中放出热量,液体有热胀冷缩的性质,如果固体溶解后,将溶液转移到容量瓶中,冷却至室温后会导致溶液体积偏小;
D.NaOH易潮解且具有强腐蚀性.
解答 解:A.定容时俯视刻度线,会导致溶液体积偏小,则配制溶液浓度偏大,故A正确;
B.n(NaOH)=$\frac{4.0g}{40g/mol}$=0.1mol,将4.0gNaOH固体溶于1L水中,溶液的体积大于1L,则导致配制溶液浓度偏小,故B错误;
C.NaOH溶解过程中放出热量,液体有热胀冷缩的性质,如果固体溶解后,将溶液转移到容量瓶中,冷却至室温后会导致溶液体积偏小,配制溶液浓度偏大,故C错误;
D.NaOH易潮解且具有强腐蚀性,所以称量NaOH固体时应该放置在小烧杯中,故D错误;
故选A.
点评 本题考查化学实验基本操作,为高频考点,明确化学实验原理、实验基本操作方法及产生误差的原因是解本题关键,易错选项是B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
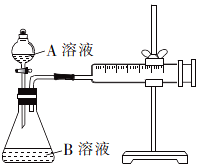 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.| 实验编号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| ② | 2mL 0.2mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| 实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | - |
| Ⅱ | 2 | 20 | 少量MnSO4粉末 |
| Ⅲ | 2 | 30 | - |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.3g | B. | 25.4g | C. | 28.6g | D. | 50.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
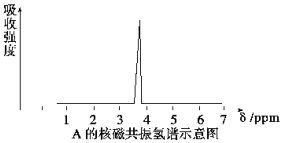 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 古有“靑蒿一握,以水二升漬,绞取汁”,今用乙醚从黄花蒿中提取靑蒿素是利用氧化还原反应原理 | |
| C. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| D. | 纤维素作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com