
向Na2S2O3和Na2S的混合溶液中缓慢滴入足量的稀H2SO4,完全反应后,得到3.20g沉淀和336mL气体(标准状况),溶液总体积为100mL,溶液中H2S的浓度为0.100mol·L-1.
(1)写出各反应的化学方程式.
(2)336mL气体是什么气体,为什么?
(3)求原混合溶液中Na2S2O3和Na2S的物质的量.
|
(1)Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓ Na2S+H2SO4=Na2SO4+H2S↑ 2H2S+SO2=H2O+3S (2)H2S气体 溶液中有H2S,SO2与H2S不能共存. (3)解:溶液中H2S的物质的量:0.100mol·L-1×0.100mol·L=0.010mol H2S气体的物质的量:336mL/22400mL·mol-1=0.0150mol 设:Na2S2O3物质的量为x 关系式:Na2S2O3~2Na2S~4S 1mol 2mol 4mol x 2x x=0.0250mol 2x=0.0500mol 所以,原混合液中n(Na2S2O3)=0.0250mol n(Na2S)=(0.0500+0.0100+0.0150)mol=0.0750mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
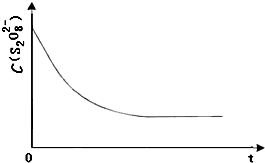 碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 0.20mol?L-1K2S2O8溶液的体积/mL | 0.10mol?L-1Na2S2O3溶液的体积/mL | H2O的体积/mL | 0.50mol?L-1KI溶液的体积 | 淀粉溶液 | |
| 实验1 | 10.0 | 4.0 | 0.0 | 4.0 | 2.0 |
| 实验2 | 9.0 | 4.0 | 1.0 | 4.0 | 2.0 |
| 实验3 | 8.0 | 4.0 | V1 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
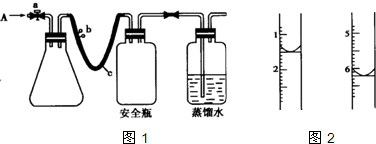
(11分)实验室用下列方法测定某水样中O2的含量。
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
实验步骤:
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 。
②用注射器抽取20.00 mL 某水样从A 处注入锥形瓶。
③再分别从A 处注入含mmol NaOH的溶液及过量的MnSO4溶液。
④关闭止水夹a、b,将锥形瓶中溶液充分振荡;
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:
MnO(OH)2+2I-+4H+==Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液及含nmol H2SO4硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程式为: I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴 作指示剂。
⑧用0.005mol · L-1Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1) 。
⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈 (填“酸性”、“碱性”或“接近中性”),其原因是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年上江西省新余一中高二上学期第一次段考化学试卷 题型:实验题
(11分)实验室用下列方法测定某水样中O2的含量。
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
实验步骤:
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 。
②用注射器抽取20.00 mL 某水样从A 处注入锥形瓶。
③再分别从A 处注入含m mol NaOH的溶液及过量的MnSO4 溶液。
④关闭止水夹a、b,将锥形瓶中溶液充分振荡;
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:
MnO(OH)2+2I-+4H+==Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液及含n mol H2SO4硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴 作指示剂。
⑧用0.005 mol · L-1Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1) 。
⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈 (填“酸性”、“碱性”或“接近中性”),其原因是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年上江西省高二上学期第一次段考化学试卷 题型:实验题
(11分)实验室用下列方法测定某水样中O2的含量。
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。

实验步骤:
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 。
②用注射器抽取20.00 mL 某水样从A 处注入锥形瓶。
③再分别从A 处注入含m mol NaOH的溶液及过量的MnSO4 溶液。
④关闭止水夹a、b,将锥形瓶中溶液充分振荡;
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:
MnO(OH)2+2I-+4H+==Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液及含n mol H2SO4硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程式为: I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴 作指示剂。
⑧用0.005 mol · L-1Na2S2O3 滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
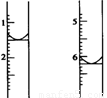
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1) 。
⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈 (填“酸性”、“碱性”或“接近中性”),其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com