
下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4 L
②0.5 mol H2所占体积为11.2 L
③标准状况下,1 mol H2O的体积为22.4 L
④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L
⑤各种气体的气体摩尔体积都约为22.4 L·mol-1
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤ B.④⑥
C.②④⑥ D.①④⑥
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜(含有少量的锌、铁、银、金等金属和少量矿物杂质)的提纯,并对阳极泥和电解液中金属进行回收和含量测定。请回答以下问题。
(1)电解时,粗铜应与电源的 极相连,阴极上的电极反应式为 ;电解过程中,硫酸铜的浓度会 (选填“变大”“不变”或“变小”)。
(2)电解完成后,该小组同学将电解液过滤后对滤液和阳极泥分别进行处理:
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
o
②Cu的回收、滤液成分及含量的测定:以下是该小组设计的一个实验流程。
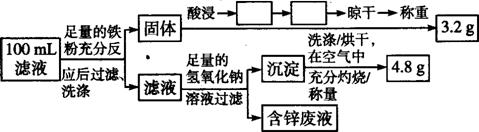
在上述流程中空格内填上相应的操作: 、 ;
100 mL滤液中Cu2+的浓度为 mol/l,Fe2+的浓度为 mol/l
查看答案和解析>>
科目:高中化学 来源: 题型:
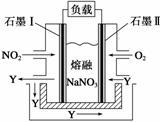
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是
Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是
A.盐桥中的K+移向乙烧杯
B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
C.在外电路中,电子从石墨电极流向银电极
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
① 此温度下,该反应的平衡常数K=________(注明单位)。
② 保持温度不变,改变CH4和CO2的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内气体平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗2a mol H2
d.混合气中n(CH4)∶n(CO2)∶n(CO)∶n(H2) =1∶1∶4∶4
③ 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=_______________ kJ·mol-1
2CO(g)+2H2(g)的△H=_______________ kJ·mol-1
 (2)用Cu2Al2O4做催化剂,一定条件下,发生反应:
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:
CO2+CH4 CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________________________ __________。
CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________________________ __________。
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是_________。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
 c. 可在ⅠA、ⅡA族元素的氧化物中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式___________ ____________________________________。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,有关电极反应可表示为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积的一种气态化合物,则该化合物的分子式为( )
A.XY3 B.XY
C.X3Y D.X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,Na+浓度最大的是( )
A.4 L 0.5 mol·L-1的NaCl溶液 B.1 L 0.3 mol·L-1的Na2SO4溶液
C.0.8 L 0.4 mol·L-1的NaOH溶液 D.2 L 0.15 mol·L-1的Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
有些食品的包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)写出生石灰可做干燥剂的理由。
(3)生石灰还可以与哪类物质发生化学反应?列举三例,并写出化学方程式。
(4)小纸袋中的物质能否长期持续地做干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些物质可做干燥剂?举例说明。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一种酸性溶液中可能存在Fe3+、N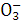 、Cl-、I-中的一种或几种,向该溶液中加入溴水,再加入淀粉,溶液变蓝。由此可推断溶液中( )
、Cl-、I-中的一种或几种,向该溶液中加入溴水,再加入淀粉,溶液变蓝。由此可推断溶液中( )
A.一定含有I-,不能 确定是否含有Cl-
确定是否含有Cl-
B.可能含有N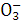 、Cl-和I-
、Cl-和I-
C.可能含有N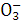
D.一定含有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com