
| A. | 用饱和Na2CO3溶液除去SO2气体中含有的少量CO2 | |
| B. | 用加热的方法提取NH4Cl固体中混有的少量单质碘 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用醋和KI淀粉溶液检验食用加碘盐中含有的碘元素 |
科目:高中化学 来源: 题型:选择题
| A. | 观察颜色 | B. | 与硝酸反应 | C. | 与盐酸反应 | D. | 测密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入酚酞显红色的溶液:Na+、Fe3+、NO3-、Cl- | |
| B. | 0.1mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| C. | 0.1mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl- | |
| D. | 水电离出的c(H+)浓度为10-12的溶液:Ca2+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向生石灰中滴加浓氨水以制备纯净的氨气 | |
| B. | 用分液漏斗分离碘和四氯化碳 | |
| C. | 用排饱和硝酸钾溶液法收集铜与浓硝酸反应产生的NO | |
| D. | 向含Al3+的氯化镁溶液中加入过量MgO,过滤得到MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
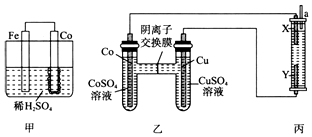 钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处.试回答下列问题:
钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com