
 反应类型加聚反应
反应类型加聚反应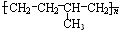 单体结构简式为CH2=CH2和CH3-CH=CH2.
单体结构简式为CH2=CH2和CH3-CH=CH2.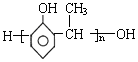 单体结构简式为
单体结构简式为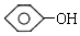 和CH3CHO.
和CH3CHO. 分析 ㈠(1)甲酸与乙醇发生酯化反应生成甲酸乙酯,该反应属于取代反应;
(2)乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯,据此写出反应的化学方程式;
(3)丙烯含有碳碳双键,可发生加聚反应生成聚丙烯;
(4)2-溴丙烷在氢氧化钠的醇溶液中发生消去反应生成丙烯、溴化钠和水;
㈡(1)链节主链有四个碳原子(无其他原子),且链节无双键的聚合物,其单体必为两种,在中央画线断开,然后两键闭合即可;
(2)苯酚和CH3CHO发生缩聚反应得到高分子化合物树脂.
解答 解:㈠(1)酯化反应的实质是:酸脱羟基醇脱氢,甲酸与乙醇反应生成甲酸乙酯,反应的化学方程式为:HCOOH+HOCH2CH3$?_{△}^{浓硫酸}$HCOOCH2CH3+H2O,该反应为酯化反应,属于取代反应,
故答案为:HCOOH+HOCH2CH3$?_{△}^{浓硫酸}$HCOOCH2CH3+H2O;取代反应(或酯化反应);
(2)乙醇在浓硫酸作用下加热到170℃,-OH转化为碳碳双键,乙醇发生了消去反应,生成乙烯,反应的化学方程式为CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)丙烯含有碳碳双键,可发生加聚反应生成聚丙烯,反应的方程式为 ,
,
故答案为: ;加聚反应;
;加聚反应;
(4)2-溴丙烷在氢氧化钠的醇溶液中发生消去反应生成丙烯、溴化钠和水,反应的化学方程式为:CH3-CHBr-CH3+NaOH$→_{△}^{氢氧化钠}$CH3-CH=CH2↑+NaBr+H2O;
故答案为:CH3-CHBr-CH3+NaOH$→_{△}^{氢氧化钠}$CH3-CH=CH2↑+NaBr+H2O;消去反应;
㈡(1)高分子化合物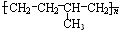 ,单体转变为在化学组成上能够重复的最小单位即链节,属于链节无双键的聚合物,单体结构简式为:CH2=CH2和CH3-CH=CH2,
,单体转变为在化学组成上能够重复的最小单位即链节,属于链节无双键的聚合物,单体结构简式为:CH2=CH2和CH3-CH=CH2,
故答案为:CH2=CH2和CH3-CH=CH2;
(2)高分子化合物 ,为酚羟基邻位的H原子与侧链中羟基脱水发生缩聚反应生成的产物,单体结构简式为:
,为酚羟基邻位的H原子与侧链中羟基脱水发生缩聚反应生成的产物,单体结构简式为: 和CH3CHO,
和CH3CHO,
故答案为: 和CH3CHO.
和CH3CHO.
点评 本题考查有机物的机构和性质,根据聚合反应产物判断其单体的方法,为高考常见题型,注意把握有机物的官能团的性质以及相关方程式的书写,明确高分子化合物为加聚反应还是缩聚反应产物,然后根据反应特点找出单体为解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 金属间发生置换反应 | |
| B. | 金属元素的最高价氧化物对应水化物的碱性强弱 | |
| C. | 1mol金属单质在反应中失去电子的多少 | |
| D. | 金属元素的单质与水或酸反应置换出氢气的难易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入Na2SiO3溶液中可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 硅的性质稳定,所以在自然界中可以以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
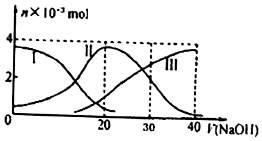
| A. | H2A在水中的电离方程式是:H2A═H++HA-、HA-?H++A2- | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+ )+c(HA- )+2c(H2A)═c(A2- )+2c(OH-) | |
| D. | 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
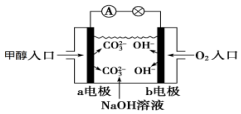 如图是甲醇燃料电池原理示意图,请回答下列问题:
如图是甲醇燃料电池原理示意图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3 | |
| B. | 正逆反应速率相等且等于零 | |
| C. | 平衡混合物中各物质的量浓度相等 | |
| D. | 单位时间内,若消耗了amolA物质,则同时也消耗了1.5amolC物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液的导电能力一定比氨水强 | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH | |
| C. | 若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 | |
| D. | 将NaOH溶液和氨水各稀释一倍,两者的c(OH-)均减小到原来的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 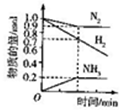 | C. | 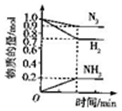 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com