

分析 (1)随温度升高,混合气体的颜色变深,说明升高温度平衡正向移动,则正反应为吸热反应;根据v=$\frac{△c}{△t}$计算v(N2O4),平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
(2)①改变温度后,N2O4的浓度降低,平衡向正反应方向移动,由于正反应吸热反应,升高温度平衡正向移动;
②平衡时,c(NO2)=0.120mol•L-1+0.0020mol•L-1•s-1×10s×2=0.16mol•L-1,c(N2O4)=0.040mol•L-1-0.0020mol•L-1•s-1×10s=0.020mol•L-1,代入平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$计算.
解答 解:(1)随温度的升高,混合气体的颜色变深,说明升高温度平衡正向移动,则正反应为吸热反应,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,v(N2O4)=$\frac{0.06mol/L}{60s}$=0.0010mol•L-1•s-1;K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{0.1{2}^{2}}{0.04}$=0.36,
故答案为:大于;0.0010mol•L-1•s-1;0.36;
(2)①改变温度后,N2O4的浓度降低,平衡向正反应方向移动,由于正反应吸热反应,升高温度平衡正向移动,故T>100℃,
故答案为:大于;c(N2O4)降低,平衡正向移动,正反应为吸热反应,故温度升高;
②平衡时,c(NO2)=0.120mol•L-1+0.0020mol•L-1•s-1×10s×2=0.16mol•L-1,c(N2O4)=0.040mol•L-1-0.0020mol•L-1•s-1×10s=0.020mol•L-1,故K2=$\frac{0.1{6}^{2}}{0.02}$=1.28,
故答案为:1.28.
点评 本题考查化学平衡计算与影响因素、平衡常数及影响因素、化学反应速率的计算等,难度不大,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 纤维素乙酸酯、油脂和蛋白质在一定条件下都能水解 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH[Ba(OH)2]:使用Na2SO4溶液 | B. | KOH(K2SO4):使用Ba(OH)2溶液 | ||
| C. | NaCl(Na2SO4):使用Ba(NO3)2溶液 | D. | HNO3(HCl):使用AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数K=0.4 | |
| B. | 反应达平衡后,升高温度,平衡正向移动 | |
| C. | 4s内,用A表示的该反应的平均反应速率v(A)=0.01mol/(L•s) | |
| D. | 830℃下反应达平衡时,B的转化率为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
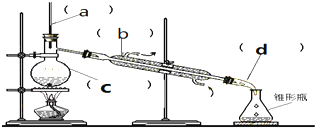
| A. | 仪器C是圆底烧瓶,加热时,液体量不超过容积的$\frac{2}{3}$,不少于容积的$\frac{1}{3}$ | |
| B. | 仪器b是直型冷凝管 | |
| C. | 仪器b中冷却水的进出方向是“下进上出” | |
| D. | 进行蒸馏操作时,温度计的下端不能放在液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 | |
| B. | 增加O2的浓度,正反应速率逐渐增大 | |
| C. | 增加SO2的浓度,平衡常数增大 | |
| D. | 若平衡时SO2的浓度比原来大,则平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com