

| A、m>n,Q<0 |
| B、m>n+P.Q>0 |
| C、m>n,Q>0 |
| D、m<n+P,Q<0 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
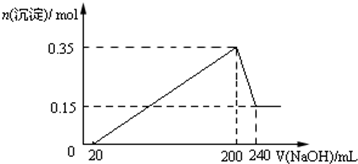
查看答案和解析>>
科目:高中化学 来源: 题型:
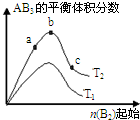 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( )| A、正反应一定是放热反应 |
| B、若T2>T1,则正反应一定是吸热反应 |
| C、达到平衡时A2的转化率大小为:b>a>c |
| D、b点时,平衡体系中A、B原子数之比接近3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在该反应中NaIO3作还原剂 |
| B、碱性条件下Na2H3IO6的氧化性小于Cl2 |
| C、反应中生成1molNa2H3IO6转移2mol电子 |
| D、反应中氧化产物与还原产物的物质的量之比为2:1. |
查看答案和解析>>
科目:高中化学 来源: 题型:
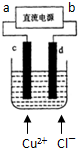
| A、a端是直流电源的负极 |
| B、通电使氯化铜发生电离 |
| C、阳极上发生的反应:Cu2++2e→Cu |
| D、通电一段时间,在阴极附近观察到有黄绿色气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在苯酚溶液中,K+、Na+、CO32-、Cl-可以大量共存 |
| B、将SO2通入FeCl3溶液,反应的离子方程式为:2Fe3++3SO2+6H2O═2Fe2++3SO42-+12H+ |
| C、标准状况下,22.4LHCl与22.4LNH3的混合气体中分子总数等于2NA |
| D、1L0.1mol?L-1明矾溶液和等浓度等体积的Ba(OH)2溶液反应,生成沉淀为BaSO4和Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com