
 ,下列对该物质叙述正确的是( )
,下列对该物质叙述正确的是( )| A. | 该物质可以进行消去反应 | |
| B. | 该物质可以进行水解反应 | |
| C. | 1 mol该物质最多可与3 mol H2反应 | |
| D. | 该物质可以和Br2进行取代反应 |
科目:高中化学 来源: 题型:选择题
| 物质(少量杂质) | 操作 | |
| A | KNO3固体(NaCl) | 加水溶解、蒸发结晶、趁热过滤、洗涤、干燥 |
| B | NaCl固体(KNO3) | 加水溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
| C | FeCl3溶液(NH4Cl) | 加热蒸干、灼烧 |
| D | NH4Cl溶液(FeCl3) | 滴加氨水至不再产生沉淀为止,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
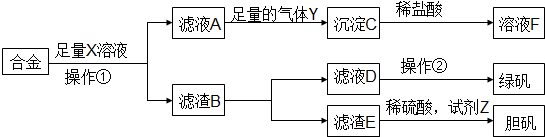
| A. | 溶液X为稀硫酸,气体Y为氨气 | |
| B. | 由溶液F获得溶质F固体的过程中,须控制条件防止其氧化和分解 | |
| C. | 使用足量稀硫酸时,试剂Z选用H2O2或适量HNO3均获得胆矾晶体 | |
| D. | 操作①为过滤,操作②为蒸发结晶、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Q | X | ||
| Y | Z | W | |
| T |
| A. | X、Z、Y元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | Q与氢元素形成的化合物中不存在非极性共价键 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,最高价氧化物对应水化物的化学式是H3TO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑦ | B. | ②⑤⑦ | C. | ①③④ | D. | ②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1000 |
| C(H2O)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| C(CO2)/mol•L-1 | 2.50 |
| A. | 在500s内用H2O(g)表示的化学反应速率是2.96×10-3mol•L-1•s-1 | |
| B. | 在500s时生成的CH4的浓度是0.74mol•L-1 | |
| C. | 在1000s时反应达到平衡 | |
| D. | 0-500s的平均反应速率大于500~1000s的平均反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
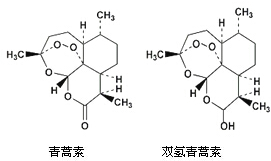 中国女药学家屠呦呦因创新性抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.下列关于青蒿素和双氢青蒿素(结构如图)说法错误的是( )
中国女药学家屠呦呦因创新性抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.下列关于青蒿素和双氢青蒿素(结构如图)说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素和双氢青蒿素均能跟氢氧化钠反应 | |
| D. | 青蒿素分子中含有过氧键和酯基、醚键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| C. | ②⑤形成的化合物阴阳离子个数比可能为1:1 | |
| D. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com