
| A. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| B. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{HCl(aq)}{→}$AlCl3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| D. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
分析 A.氯化铁加热促进水解,生成的HCl易挥发,则加热得不到氯化铁;
B.氧化铝与NaOH溶液反应,偏铝酸钠与盐酸反应;
C.氨气催化氧化生成NO,NO与氧气、水反应生成硝酸;
D.先通入氨气,再与食盐水、二氧化碳反应生成碳酸氢钠,碳酸氢钠加热分解生成碳酸钠.
解答 解:A.氯化铁加热促进水解,生成的HCl易挥发,则加热得不到氯化铁,应在HCl气流中蒸发,则Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$→_{△}^{HCl气流中}$无水FeCl3,故A错误;
B.氧化铝与NaOH溶液反应生成偏铝酸钠,偏铝酸钠与足量盐酸反应生成氯化铝,则Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{HCl(aq)}{→}$AlCl3可实现,故B正确;
C.氨气催化氧化生成NO,NO与氧气、水反应生成硝酸,则NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2},H_{2}O}{→}$HNO3可实现,故C正确;
D.先通入氨气,再与食盐水、二氧化碳反应生成碳酸氢钠,碳酸氢钠加热分解生成碳酸钠,则饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3可实现,故D正确;
故选A.
点评 本题考查元素及化合物的性质,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意选项A中水解的应用,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
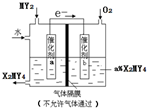 X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题:
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题: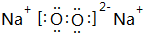 ;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L溶液中含有0.3NA个K+离子 | |
| B. | 1L溶液中含有K+和SO42-离子总数为0.9NA | |
| C. | 2L溶液中含K+的物质的量浓度为1.2mol/L | |
| D. | 2L溶液中含0.6NA个SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
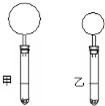 右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )
右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )| A. | 乙试管中盛放的是盐酸溶液 | |
| B. | 甲试管中盛放的是醋酸溶液 | |
| C. | 反应开始时的速率:甲>乙 | |
| D. | 反应结束时消耗碳酸钙的质量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
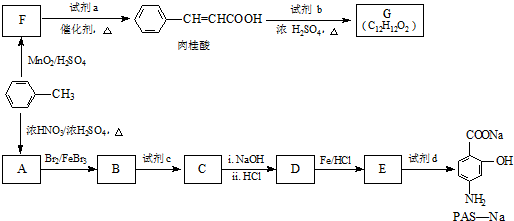
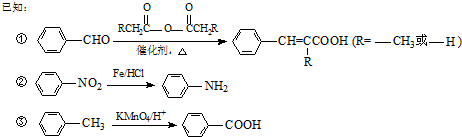
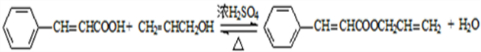
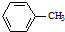 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.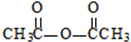 .
.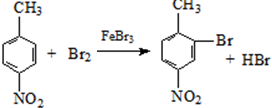 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
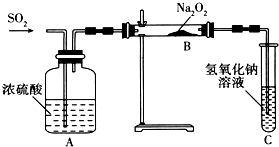
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 四种短周期主族元素A、B、C、D均属于非金属元素,它们在周期表中的位置如图所示.请回答列问题:
四种短周期主族元素A、B、C、D均属于非金属元素,它们在周期表中的位置如图所示.请回答列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com