
【题目】
GaN是制造5G芯片的材料,氮化镓和氮化铝LED可发出紫外光。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____ (填“大于”或“小于”,下同)As。
(3)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为____,其中的阴离子的空间构型为____。
(4)组成相似的CaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是________。
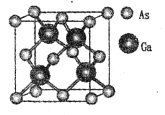
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为 ___;紧邻的As原子之间的距离为b,紧邻的As、Ca原子之间的距离为d,则b:d=____,该晶胞的密度为__g cm-3。(阿伏加德罗常数用NA表示)
【答案】3d104s24p1 小于 ![]() 直线形 Cl-的电子层比F-的多,原子半径比F-的大,正负离子半径相差较大的GaF3是离子键,形成离子晶体,正负离子半径相差小的GaCl3是共价键,形成分子晶体 16
直线形 Cl-的电子层比F-的多,原子半径比F-的大,正负离子半径相差较大的GaF3是离子键,形成离子晶体,正负离子半径相差小的GaCl3是共价键,形成分子晶体 16 ![]()
![]()
【解析】
(1)Ga处于周期表中第4周期第ⅢA族,根据核外电子排布规律书写;
(2)同周期主族元素,随着元原子序数增大,电负性增大;
(5)紧邻的两个As原子的距离为顶点到面心的距离b=![]() ,紧邻的As、Ga原子之间的距离d为
,紧邻的As、Ga原子之间的距离d为![]() ;晶胞中Ga个数=4,As个数=
;晶胞中Ga个数=4,As个数=![]() 个,晶胞体积=(a×10-10)3cm3,晶体密度为
个,晶胞体积=(a×10-10)3cm3,晶体密度为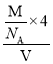 。
。
(1)Ga处于周期表中第4周期第ⅢA族,则基态Ga原子的核外电子排布式为:[Ar]3d104s24p1;
(2)同周期主族元素,随着元原子序数增大,电负性增大,所以元素的电负性Ga小于As;
(3)阳离子“N5n+”,其结构是对称的,5个N排成“V”形,则中间N原子有2对共用电子对,如果5个N结合后都达到8电子结构,共需要5×8=40个价电子;5个N原子共有5×5=25个价电子,含有2个N≡N以及中间N原子有2对共用电子对,通过共用增加了2×8=16个价电子,共25+16=41个价电子,而达到稳定结构只需要40个,因此失去1个价电子,则该阳离子为N5+,阴离子为N3-。则离子化合物的电子式为![]() 。N3-中间N的价层电子数对
。N3-中间N的价层电子数对![]() ,中间N原子采用sp杂化,该阴离子为直线形;
,中间N原子采用sp杂化,该阴离子为直线形;
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体,从F-和Cl-结构考虑,F-的电子层小于Cl-,F-的半径小于Cl-,不易被极化,Cl-的变形性大于F-,被极化程度增大,使从GaF3向GaCl3变化时,键型从离子键向共价键变化;答案Cl-的电子层比F-的多,原子半径比F-的大,正负离子半径相差较大的GaF3是离子键,形成离子晶体,正负离子半径相差小的GaCl3是共价键,形成分子晶体;
(5)一个Ga与周围4个As形成共价键,所以晶胞内存在共价健数为16;
紧邻的两个As原子的距离为顶点到面心的距离b=![]() ,紧邻的As、Ga原子之间的距离d为
,紧邻的As、Ga原子之间的距离d为![]() ;则b:d=
;则b:d=![]() :
:![]() =
=![]() ;
;
晶胞中Ga个数=4,As个数=![]() 个,晶胞体积=(a×10-10)3cm3,晶体密度
个,晶胞体积=(a×10-10)3cm3,晶体密度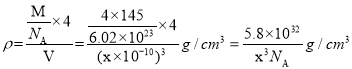 。
。


科目:高中化学 来源: 题型:
【题目】储氢材料是一类能可逆地吸收和释放氢气的材料。LaNi5合金、NaBH4、H3B-NH3、Mg2NiH4等都是潜在储氢材料。回答下列问题:
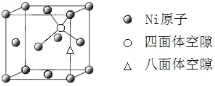
(1)基态Ni原子的核外电子排布式为____,有___________个未成对的电子;
(2)NaBH4中H为-1价,Na、B、H电负性由大到小的顺序是_________。BH4-离子的立体构型为________,其中B的杂化轨道类型为_____。
(3)B2H6和NH3化合可以生成H3B-NH3,H3B-NH3加热时发生反应:H3B-NH3=BN+3H2,缓慢释放出H2。BN有类似于石墨的结构,B2H6、NH3和BN的沸点由高到低的顺序为_________, 原因是___。
(4)X-射线衍射分析表明,Mg2NiH4 的立方晶胞的面心和顶点均被Ni原子占据,所有Mg原子的Ni配位数都相等。则Mg原子填入由Ni原子形成的_____空隙中(填“四面体”或“八面体”),其空隙占有百分率为_____。
(5)已知Mg2NiH4 晶体的晶胞参数为646.5 pm,液氢的密度为0.0708 g·cm-3。若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则Mg2NiH4 的储氢能力是液氢的___倍(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国药物学家最近合成一种可能用于治疗高血压的有机物K,合成路线如下:
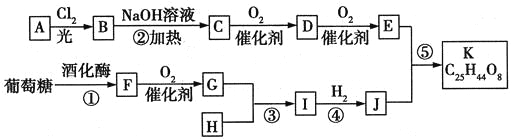
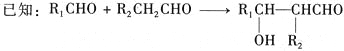
其中A属于碳氢化合物,其中碳的质量分数约为83.3%;E的核磁共振氢谱中只有2组吸收峰。H常温下呈气态,是室内装潢产生的主要污染物之一。G和H以1:3反应生成I。
试回答下列问题:
(1)A的分子式为:______________。
(2)写出下列物质的结构简式:D:____________;G:___________。
(3)反应①―⑤中属于取代反应的有___________。
(4)反应①的化学方程式为_______________;反应④的化学方程式为_________________。
(5)E有多种同分异构体,符合“既能发生银镜反应又能发生水解反应”条件的E的同分异构体有_______种,写出符合上述条件且核磁共振氢谱只有2组吸收峰的E的同分异构体的结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸酯类物质广泛用于建筑、包装材料等,丙烯酸是合成丙烯酸酯的原料之一。丙烯醇可用于生产甘油、塑料等。以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:

已知:
①2CH2=CH-CHO+NaOH![]() CH2=CHCH2OH+CH2=CHCOONa
CH2=CHCH2OH+CH2=CHCOONa
②2CH2=CHOONa+H2SO4→2CH2=CHCOOH+Na2SO4
③有关物质的相关性质如表:
物质 | 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | - 87 | - 129 | 13 | -22.8 |
密度/g·mL-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和有机溶剂 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 难溶于水 |
(1)操作①需要连续加热30min,所用装置如图所示。仪器L名称是________。

(2)操作②使用的主要仪器是分液漏斗,在使用之前需进行的操作是 ___。
(3)操作④包括____、过滤、冰水洗涤、低温吸干。
(4)操作⑤中,加热蒸馏“下层液体”,分离出四氯化碳;再分离出丙烯醇(如图),要得到丙烯醇应收集 ____(填温度)的馏分。图中有一处明显错误,应改为____。

(5)测定丙烯醇的摩尔质量:准确量取amL丙烯醇于分液漏斗中,烧瓶内盛装足量钠粒。实验前量气管B中读数为b mL,当丙烯醇完全反应后,冷却至室温、调平B、C液面,量气管B的读数为c mL。已知室温下气体摩尔体积为VL·mol-1。

调平B、C液面的操作是____;实验测得丙烯醇的摩尔质量为____g·mol-1(用代数式表示)。如果读数时C管液面高于B管,测得结果将____(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.丙烯的结构简式为 CH3CHCH2
B.结构为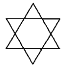 的有机物的分子式为 C12H12
的有机物的分子式为 C12H12
C.分子式为 C4H9Cl 的同分异构体共有 5 种
D.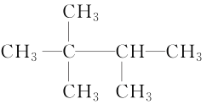 与(CH3)3CCH(CH3)2 不是同一物质
与(CH3)3CCH(CH3)2 不是同一物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铝(AlPO4)是一种用途广泛的材料,在建筑、耐火材料、化工等方面具有广泛的应用前景。以磷硅渣(主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等)为原料制备磷酸铝的工艺流程如图所示:

回答下列问题:
(1)酸浸液中含磷元素的主要粒子是_____(填化学式,下同),浸渣中的主要化学成分是_____。
(2)生石灰除了调节pH外,另一作用是_____。
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为_____。
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是_____ (填化学式)。
(5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图所示:

则最优反应条件是_____。
(6)固相反应制备磷酸铝的方法之一是在900℃的焙烧炉内加热磷酸二氢铵与氧化铝混合物,写出该反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】司替戊醇(d)用于治疗两岁及以上Dravet综合征相关癫痫发作患者,其合成路线如图所示。下列有关判断正确的是( )

A.b的一氯代物有4种
B.c的分子式为C14H14O3
C.1mold最多能与4molH2发生加成反应
D.d中所有碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是恒温条件下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )

A.反应达到平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.10 mol/L的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.050 mol/L的盐酸、磷酸及谷氨酸(H2G),滴定曲线如图所示:
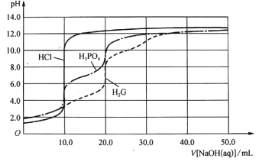
下列说法正确的是
A.滴定盐酸时,用甲基橙作指示剂比用酚酞更好
B.H3PO4与H2G的第一电离平衡常数K1的数量级不同
C.用酚酞作指示剂滴定磷酸到终点时,溶液中的溶质为Na2HPO4
D.NaH2PO4溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com