
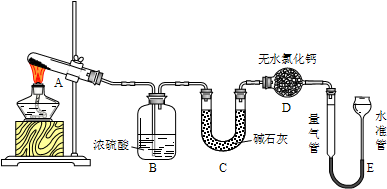
| 实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
| ① | T1 | 0.640 | 0.320 | 0 | 0 |
| ② | T2 | 0.640 | 0 | 0.256 | V2 |
| ③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
| ④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
| 0.64g |
| 160g/mol |
| 0.256g |
| 64g/mol |
| 0.064g |
| 32g/mol |
| ||
| 0.64g |
| 160g/mol |
| 0.0224 |
| 22.4 |
| 0.64g |
| 160g/mol |
| 0.256g |
| 64g/mol |
| 0.064g |
| 32g/mol |
| ||
| ||
| 0.64g |
| 160g/mol |
| 0.0224 |
| 22.4 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
 (1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式
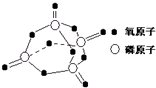
(1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com