
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选 项 | ① | ② | ③ | 实验结论 |
|
| A. | 稀 硫 酸 | Na2S | AgNO3与 AgCl的 浊液 | Ksp(AgCl)> Ksp(Ag2S) | |
| B. | 浓 硫 酸 | 蔗糖 | 溴水 | 浓硫酸具有脱 水性、氧化性 | |
| C. | 稀 盐 酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性 钡盐均可生成 白色沉淀 | |
| D. | 浓 硝 酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸> 碳酸>硅酸 |
科目:高中化学 来源: 题型:
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
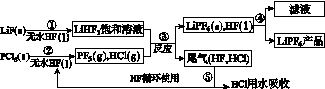
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是________________、________________。反应设备不能用玻璃材质的原因是______________________________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________________________________。
(3)第④步分离采用的方法是________;第⑤步分离尾气中HF、HCl采用的方法是________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验可实现鉴别目的的是( )
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO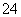 )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是__________________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O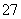 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、____________________和__________________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或说法错误的是( )
A.蒸发时,蒸发皿中的固体不能蒸干才停止加热
B.蒸馏时,温度计的水银球应靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
D.焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色
查看答案和解析>>
科目:高中化学 来源: 题型:
将钠、镁各O.2 m01分别放入100 mL 1 mol/l的盐酸中, 同温同压下产生的气体体积之比是 ( )
A.1:2 B.1:3 C.2:1 D.1:l
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
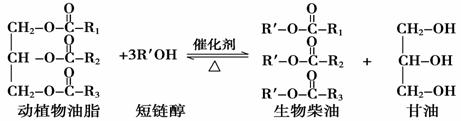
下列叙述错误的是( )
A.生物柴油由可再生资源制得 B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物 D.“地沟油”可用于制备生物柴油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com