
分析 A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大.E2-与Ar原子具有相同的电子层结构,可推知E为S元素,C与E同主族,则C为O元素;B与C同周期且相邻,可推知B为N元素;A与D同主族,可形成DA型离子化合物,二者只能处于IA则,可推知A为氢元素,D为Na;W的合金用量最大、用途最广,则W为Fe.
解答 解:A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大.E2-与Ar原子具有相同的电子层结构,可推知E为S元素,C与E同主族,则C为O元素;B与C同周期且相邻,可推知B为N元素;A与D同主族,可形成DA型离子化合物,二者只能处于IA则,可推知A为氢元素,D为Na;W的合金用量最大、用途最广,则W为Fe.
(1)W为Fe元素,在元素周期表中的位置为:第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)A.同周期自左而右原子半径增大,一般电子层越多原子半径越多,可知原子半径:A(H)<C(O)<B(N)<E(S)<D(Na),故A错误;
B.Na2FeO4中Fe为+6价,具有强氧化性,还原得到Fe3+水解生成氢氧化铁胶体,可以用来做消毒剂和净水剂,故B正确;
C.A4B2C3为NH4NO3,既含有离子键又含有共价键,故C正确;
D.Na2O2具有强氧化性,与SO2可以反应生成Na2SO4,故D错误,
故选:BC;
(3)B的最高价氧化物对应水化物为HNO3,灼热的碳能与浓硝酸反应生成二氧化氮、二氧化碳与水,化学反应方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+4NO2↑+2H2O;
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeSO4溶液,溶液变成棕黄色,说明Fe2+被氧化为Fe3+,发生反应的离子方程式为:H2O2+2H++2Fe2+=2Fe3++2H2O,一段时间后,溶液中有大量气泡出现,随后溶液温度升高,有红褐色沉淀生成,则产生气泡的原因是:Fe3+催化H2O2分解产生O2;生成沉淀的原因是:温度升高,促进Fe3+水解平衡向正向移动,
故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;Fe3+催化H2O2分解产生O2;温度升高,促进Fe3+水解平衡向正向移动.
点评 本题以元素推断为载体,考查元素周期表与元素周期律、原子结构、元素化合物知识、信息获取与迁移应用能力等,是对学生综合能力的考查,难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
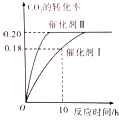 已知CO2可生成绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃时密闭容器中,当c(CO2)=1.00mol/L、c(H2)=1.60mol/L开始反应,结果如图所示,回答下列问题:
已知CO2可生成绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃时密闭容器中,当c(CO2)=1.00mol/L、c(H2)=1.60mol/L开始反应,结果如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、CO32-、NO3- | B. | Mg2+、NH4+、SO42-、Cl- | ||
| C. | Fe3+、K+、NO3-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2倍 | B. | 1.5倍 | C. | 0.9倍 | D. | 0.5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除水垢 | |
| B. | 甘油加水作护肤剂 | |
| C. | 双氧水漂白美容 | |
| D. | 烹鱼时,加入少量的料酒和食醋可减少腥味,增加香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com