
【题目】将等物质的量A、B混合于2 L的密闭容器中,发生如下反应:![]() ,经5 min后,测得D的浓度为0.5 molL-1,
,经5 min后,测得D的浓度为0.5 molL-1,![]() ,
,
C的平均反应速率是0.1 molL-1min-1
求:(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值是多少?
【答案】(1)0.75 mol/L, n(A)= 3moL n(B)=3moL
(2)0.05mol/(L·min) (2分) (3) x=2(2分)
【解析】
试题分析:(1)设原混合物中A、B的物质的量为a,列出起始时和5min时有关物质的物质的量。
3A(g)+B(g)![]() xC(g) + 2D(g)
xC(g) + 2D(g)
起始时(mol) a a 0 0
5min时(mol) a-1.5 a-0.5 0.1×2×5 0.5×2
根据c(A)∶c(B)=3∶5,可得![]() =
=![]() ,解得a=3
,解得a=3
即n(A)=n(B)=3mol,5min时c(A)=![]() =0.75mol/L。
=0.75mol/L。
(2)v(B)=![]() =0.05mol/(L·min)。
=0.05mol/(L·min)。
(3)由化学计量数之比等于物质的量的变化量之比,则![]() =
=![]() ,解得x=2。
,解得x=2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
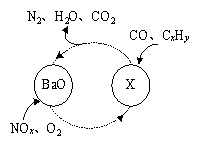
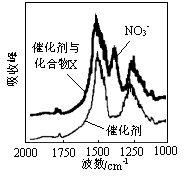
图1 图2
①在图示的转化中,被还原的元素是 ,X的化学式为 。
②氮元素在周期表中的位置是 。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式: 。已知NOx与NH3的反应△H<0,为提高氮氧化物的转化率可采取的措施是 (任写一条)。
(3)利用ClO2 氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的化学方程式是2NO + ClO2 + H2O == NO2 + HNO3 + 2HCl,反应Ⅱ的离子方程式是 。
(4)加入过量次氯酸钠可使废水中NH4+ 完全转化为N2,而本身被还原为NaCl。
①写出次氯酸钠的电子式_________________。
②检验废水中是否存在NH4+的方法是 。
③若处理废水产生了0.448 L N2(标准状况),则需消耗浓度为2 mol·L-1的次氯酸钠的体积为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质。通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/L r溶液的![]() 为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是
为2,p是甲烷。上述物质的转化关系如图所示。下列说法正确的是
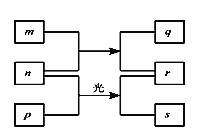
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.![]() 的氢化物常温常压下为气态
的氢化物常温常压下为气态
D.![]() 的最高价氧化物对应的水化物为弱酸
的最高价氧化物对应的水化物为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关,下列有关说法中正确的是
A. “低碳生活”是指生活中尽量使用含碳量较低的物质
B. 燃煤中加入CaO后可减少酸雨的发生
C. 高纯铝被大量用于制造火箭、导弹和飞机的部件
D. 食品包装袋内的铁粉和生石灰的作用原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学欲研究SO2的相关性质。
(1)比较下表中的两组物质关系,第2组中物质X的化学式是 。
第1组 | 第2组 |
C、CO、CO2、H2CO3、Na2CO3、、NaHCO3、 | S 、SO2、SO3、X、Na2SO4、NaHSO4 |
(2)利用下图装置来检验SO2的性质
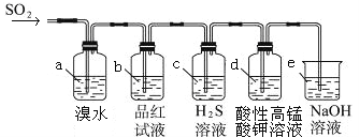
①装置a中的现象是: ; (填“能”或“不能”)说明SO2有漂白性
②若装置e中有40 mL 2.5 molL-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
(3)该小组的甲、乙两位同学利用下图装置继续探究SO2及氯气漂白性:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,用离子方程式表示品红溶液不褪色的原因是: 。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,化学性质稳定,用途广泛。 工业上以铬铁矿[主要成分是 Fe(CrO2)2]为原料冶炼铬及获得强氧化性 Na2Cr2O7,其工艺流程如下图所示:
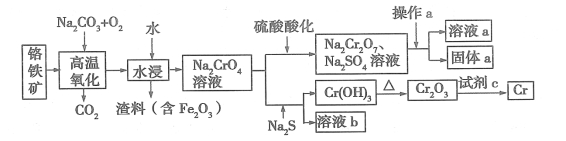
 (1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(2)写出利用铝热反应制取铬的化学方程式: ,试剂 c 通常还可以是 (至少写两种) 。
(3)酸化过程中,不选用盐酸的原因是 。
(4)固体 a 的主要成分是 Na2SO4·10H2O,根据图分析,操作a为 、 、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
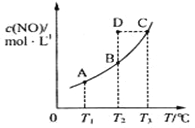
A.该反应的△H>0
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中( )
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com