
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应②中相关化学键键能数据如下:
化学键 | H-H | C=O | C≡O | H-O |
E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随温度升高而增大,490K之后,甲醇产率随温度升高而减小的原因分别是____。
②一定能提高甲醇产率的措施是____。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。

①490K时,根据曲线a、c判断合成甲醇的反应机理是____(填“I”或“II”)。
Ⅰ.CO2![]() CO
CO![]() CH3OH II.CO
CH3OH II.CO![]() CO2
CO2![]() CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应①、②分析原因____。
【答案】36 99 不是 升高温度,反应逆向移动,催化剂活性降低 AC Ⅱ CO促进反应Ⅱ逆向移动,CO和H2的量增加,水蒸气的量减少
【解析】
(1)根据题中所给键能数据,计算得到方程②的反应热为:△H2=(803×2+436-1076-2×465)=36 kJ·mol-1;方程③可以用方程②-①获得,△H2-△H1=36-(-63)=99 kJ·mol-1;综上所述,本题答案是:36;99。
(2)①温度为470K时,图中P点不是处于平衡状态;在490K之前,甲醇产率随着温度升高而增大的原因是温度越高化学反应速率越快,490K之后,甲醇产率下降的原因是升高温度,反应i逆向移动,催化剂活性降低;综上所述,本题答案是:不是;升高温度,反应逆向移动,催化剂活性降低。
②A.增大压强,反应Ⅰ平衡正向移动,甲醇产率可以提高,故A正确;
B,升高温度反应Ⅰ是放热反应,平衡逆向移动,甲醇产率降低,故B错误;
C.选择合适催化剂,选择生成甲醇,提高甲醇产率,故C正确;
D.加入大量催化剂,不能影响平衡,故D错误;
综上所述,本题选AC。
(3)图2为一定比例的CO2/H2、CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
490K时,从甲醇的生成速率来看,a曲线大于c曲线,即甲醇来源于CO2和H2,故490K时,根据曲线a、c判断合成甲醇的反应机理是Ⅱ;
490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ⅱ分析原因:对ii. CO2(g)+ H2(g)![]() CO(g)+H2O(g),CO是生成物,CO促进反应Ⅱ逆向移动,二氧化碳和氢气的量增加,水蒸气的量减少,i.CO2(g)+3H2(g)
CO(g)+H2O(g),CO是生成物,CO促进反应Ⅱ逆向移动,二氧化碳和氢气的量增加,水蒸气的量减少,i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)正向进行,故CO的存在使甲醇生成速率增大;
CH3OH(g)+H2O(g)正向进行,故CO的存在使甲醇生成速率增大;
综上所述,本题答案是:Ⅱ ;CO促进反应Ⅱ逆向移动,CO和H2的量增加,水蒸气的量减少。


科目:高中化学 来源: 题型:
【题目】下列关于水的说法正确的是
A.我们平时应多饮用纯净水,防止有毒物质进入体内
B.所有天然水都可以直接饮用
C.含有较多钙、镁离子的水叫硬水
D.人体内含水量约占体重的2/3,故人每天不用喝水也可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下装置![]() 略去部分夹持仪器
略去部分夹持仪器![]() 制取
制取![]() 并验证其性质.
并验证其性质.
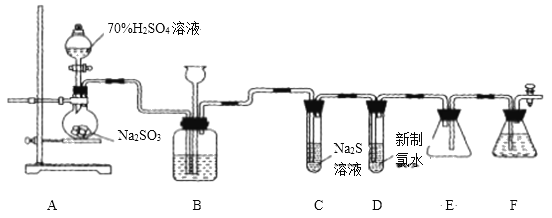
(1)盛装![]() 的仪器名称为__________
的仪器名称为__________ ![]() ,还缺少的玻璃仪器是________,用
,还缺少的玻璃仪器是________,用![]() 的化学方程式_______.
的化学方程式_______.
(2)装置B的作用之一是通过观察产生气泡的多少判断![]() 生成的快慢,其中的液体最好选择____
生成的快慢,其中的液体最好选择____![]() 填代号
填代号![]() .
.
a. 饱和![]() 溶液 b. 饱和
溶液 b. 饱和![]() 溶液
溶液
c. 饱和![]() 溶液 d. 饱和NaHSO3溶液
溶液 d. 饱和NaHSO3溶液
(3)验证二氧化硫的氧化性的装置是______,现象为_______________.
(4)为验证二氧化硫的还原性,充分反应后,取该试管中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入![]() 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入![]() 溶液,产生白色沉淀.
溶液,产生白色沉淀.
上述方案合理的是方案________![]() 填“I”、“Ⅱ”或“Ⅲ”
填“I”、“Ⅱ”或“Ⅲ”![]() ;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为____________________.
;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为____________________.
(5)装置F的作用是___________________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)===CO2(g)+3H2(g)。下图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH________0(选填“>”“=”或“<”)。
②图中途径(Ⅱ)的条件是__________________,途径(Ⅰ)的反应热________途径(Ⅱ)的反应热(选填“>”“=”或“<”)。
③在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为__________________________________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在______中,再加水稀释,这样操作的目的是__________________________________________。
(2)通入足量SO2时,装置C中观察到的现象为___________________________________。
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式____________________________________;
②请设计实验方案检验有Fe2+ 生成___________________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42 -,该做法____(填“合理”或“不合理”),理由是__________。
(4)D装置中倒置漏斗的作用是_________________________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有____________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:

(1)“酸浸”时需加入过量的稀硫酸,目的是提高浸取率和________;滤渣的主要成分是__________。
(2)“氧化”过程中,加入H2O2发生反应的离子方程式为____________。
(3)“提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=_________。
(4)已知Ksp[Fe(OH)3]=1×10-39。“提纯”过程中,当c(Fe3+)<10-6 mol ·L-1时,溶液中c(OH-)>________mol ·L-1。
(5)“沉淀”过程中,通入过量CO2时发生反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的的是( )
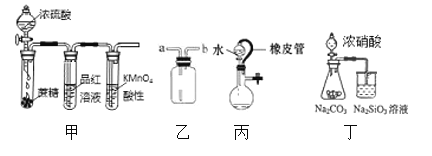
A. 用甲装置验证浓H2SO4的脱水性、强氧化性
B. 用乙装置收集NO气体
C. 装置丙中水能持续流下,说明装置气密性不良好
D. 用丁装置比较N、C、Si非金属性的强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com