
| A. | 只有①②③ | B. | 只有①②③⑤⑥ | C. | 只有①②③⑥ | D. | ①②③④⑤⑥ |
分析 中学常见既能与盐酸反应又能与氢氧化钠溶液反应的物质有:两性化合物[如Al2O3、Al(OH)3等]、弱酸的铵盐[如(NH4)2CO3等]、弱酸的酸式盐[NaHCO3、NaHS等]、单质(如Al)、氨基酸、蛋白质等.
解答 解:①Al与盐酸反应生成氯化铝与氢气,与氢氧化钠反应反应生成偏铝酸钠与氢气,故①符合;
②Al(OH)3 属于两性氢氧化物,既能和盐酸反应生成盐和水,又能和氢氧化钠溶液反应生成盐和水,故②符合;
③Al2O3 属于两性氧化物,既能和盐酸反应生成盐和水,又能和氢氧化钠溶液反应生成盐和水,故③符合;
④AlCl3 能与氢氧化钠溶液反应,但不能与盐酸反应,故④不符合;
⑤NaAlO2 能与盐酸反应,但不能与氢氧化钠溶液反应,故⑤不符合;
⑥NaHCO3属于弱酸酸式盐,能和盐酸反应生成氯化钠、二氧化碳与水,能和氢氧化钠溶液反应生成碳酸钠与水,故⑥符合,
故选:C.
点评 本题考查元素化合物的性质,难度不大,明确物质的性质是解本题的关键,归纳总结中学常见的既能与酸反应又能与碱反应的物质.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
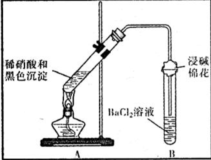 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
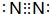 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com